NK 细胞简化高效扩增试剂盒说明书
产品介绍
新鲜脐带血/成人外周血培养方案(2.5L体系)
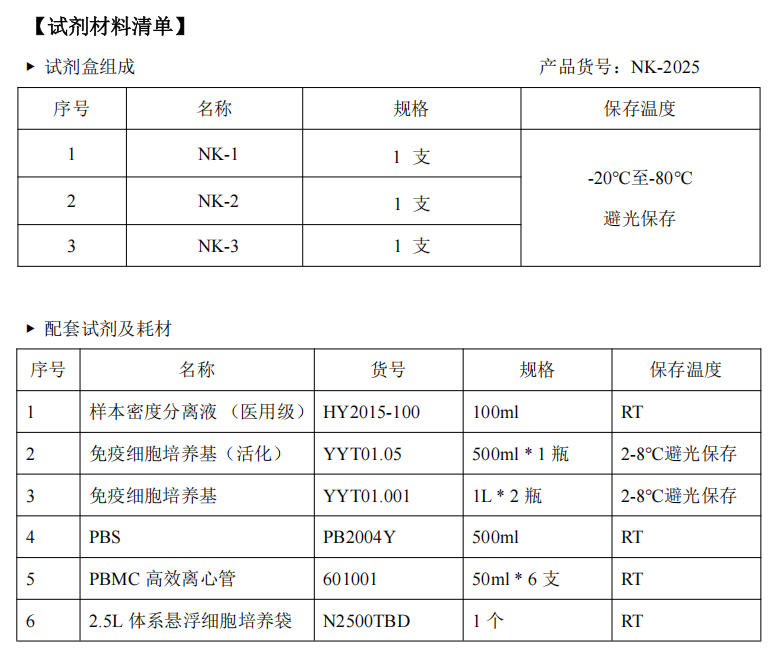
【产品介绍】
1. NK 试剂盒通用于脐带血及健康人外周血 NK 细胞培养;
2. 组分采用药用级激活抗体组合,化学成分明确,无异源成分,无滋养层细胞;
3. 试剂盒组合仅 3 支试剂,无需包被步骤,无繁杂配制流程及易混淆步骤;
4. 扩增能力强,以单个核细胞为样本,无需前期分选工作;
5. cGMP 标准下,采用一次性生产工艺,保证产品稳定性、一致性。
新鲜脐带血 CBMC 初始投入方案
脐带血中 NK 细胞(CD3- 56+ 16+)占淋巴细胞比例约为 3%-5%之间,其比例远远低于 成年人外周血。
而 NK 的细胞原始比例是体外培养的关键因素,当 NK 细胞原始比例低于 5%,会显著减缓体外活化及增殖速率。
一般 200ml 规格采血袋内含 28-30ml 抗凝剂,建议采集脐带血量为 100ml 以上(除去抗 凝剂体积)。
可获得 CBMC 约 2 亿-3 亿之间。 建议客户在实验开始前,将采集的脐带血留出 1ml 进行流式检测,记录 NK 细胞比例 (CD3- 56+ 16+)、细胞数量、细胞活率。
并参照下表进行初始细胞投入。

新鲜脐血差异影响 NK 细胞体外活化增殖的因素
1. NK 细胞在新鲜脐带血中的原始比例:其占比越高增殖及活化效果越好;
2. 细胞活率:细胞活率越高增殖及活化效果越好;
3. 健康状况:未用药、无急慢性病产妇其培养效果佳; 长期用药、放化疗或使用过免疫系统类药物的人群培养结果波动性较大。
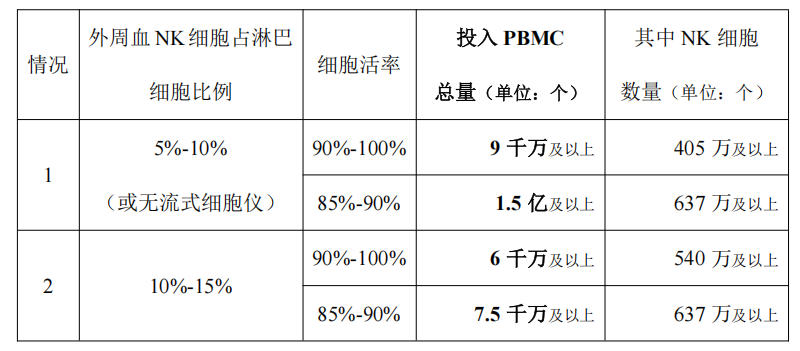
新鲜成人外周血 PBMC 细胞初始投入方案
由于不同个体外周血原始 NK 细胞数量占淋巴细胞数量比例差异性较大(健康成年人 NK 细胞占淋巴细胞比例约为 5%-15%之间)。推荐采集外周血量为 50-70ml(除去抗凝剂 体积)。可获得 PBMC 约 6 千万-1.5 亿之间。 建议客户在实验开始前,将采集的外周血留出 1ml 进行流式检测,记录 NK 细胞比例 (CD3- 56+ 16+)、细胞数量、细胞活率。并参照下表进行初始细胞投入。
个体差异影响 NK 细胞体外活化增殖的因素
1. NK 细胞在外周血中的原始比例:其占比越高增殖及活化效果越好;
2. 年龄:健康人在 18-65 岁范围内,年龄越小培养效果越好。大于 65 岁人群其培养结果波 动性较大。
3. 健康状况:未用药、无急慢性病人群其培养效果佳; 长期用药、放化疗或使用过免疫系统类药物的人群培养结果波动性较大。
NK 活化及培养流程(2.5L 体系)
第一部分 培养基的配制
▷ 活化培养基的配制
1. DAY0 需使用未加入任何因子的基础培养基,请于 DAY0 操作流程完成后配制活化 培养基。
2. 本套装包含一瓶 500ml 免疫细胞无血清培养基(活化)(产品货号:YYT01.05),加入 1 整支 NK-2 摇匀即为 500ml 活化培养基。使用时现用现配,活化培养基可在 4℃环境下 保存 20 天左右。
▷ 增殖培养基的配制
本套装包含两瓶 1L 免疫细胞无血清培养基(产品货号:YYT01.001),加入 500ul NK-3 摇匀即为增殖培养基。
使用时现用现配,增殖培养基可在 4℃环境下保存 20 天左右。
先使用第一瓶,用完后再配制第二瓶。
1. 第一瓶:1L 免疫细胞无血清培养基中加入 500ul NK-3。(剩余 500ul NK-3 置于 4℃ 环境保存,最长可保存 20 天);
2. 第二瓶:1L 免疫细胞无血清培养基中加入剩余 500ul NK-3。
第二部分 脐带血/外周血采集
脐带血
1. 临床获得健康新生儿脐带血 100ml 以上(不含抗凝剂)。(首选肝素钠抗凝剂)
2. 请保证血液在安全无菌且温度为 20-30℃条件下平稳运送至实验室。
3. 新鲜脐带血 CBMC 最佳分离时间为取血后 2 小时内。如达不到 2 小时内分血条件,请务 必于 4 小时内进行分血步骤,超过 4 小时很难顺利进行分离。
外周血
1. 使用一次性负压采血管抽取自体外周血 50-70ml。(首选肝素钠抗凝剂)
2. 请保证血液在安全无菌且温度为 20-30℃条件下平稳运送至实验室。
3. 新鲜血液 PBMC 最佳分离时间为取血后 2 小时内。如达不到 2 小时内分血条件,请务必 于 4 小时内进行分血步骤,超过 4 小时很难顺利进行分离。
操作释义: 1. 肝素钠抗凝剂的必要性:由于血浆中的纤维蛋白原活化成有活性的纤维蛋白,纤维蛋白 交联成纤维蛋白血凝块,易使 CBMC 形成细胞团块,不利于细胞的活化。肝素钠抗凝剂可减 轻上述情况发生几率。 2. 运输条件需保持常温状态(20℃-30℃),严禁冷藏冷冻运输及长期放置(4 小时以上), 尽量平稳送至实验室,减少不必要的摇晃震动。低温、震荡或长期放置会导致红细胞破裂, 血液理化性质发生改变,严重影响 CBMC 分离效果及细胞健康状态。
第三部分 NK 细胞的活化及培养流程(2.5L 体系)
第 0 天:
1. 取出 2-4 支高效离心管,分别加入 16 ml 样本密度分离液,200g 离心 1min,确保离心后 隔片下充满分离液,隔片上有 0.5-25px 高度分离液。小心将 15-25ml 抗凝血缓慢沿管壁加至 分离液界面上,确保血液与分离液之间有明显界面(每管可加 15-25ml 血液,若血量超过 25ml,则分管操作)。20-30℃环境下,离心力 600g,离心 30min(也可根据实际情况进行 调节),注意离心机速度为慢升慢降。
2. 离心后可观察从上至下分为 4 层,淡黄色血浆层,白色环状 P/CBMC 层,分离液层,红 细胞层。用吸管吸取最上层淡黄色血浆(每 50-60ml 抗凝血约可获得 20-25ml 血浆),放置 于无菌离心管中做灭活处理。 操作注意: 吸取血浆层时,吸管头请从上至下吸取,吸取至距离白色环状 P/CBMC 约 2mm 处时即可。如 过分贴近 P/CBMC 层,可能造成 P/CBMC 的损失。
血浆的灭活步骤:
1) 首先将含血浆的离心管置于水浴锅中 56℃ 静置 30min;
2) 接着放置于-20℃环境下静置 10min;
3) 最后 1200g,离心 15min;
4) 保存离心后的上清至一支新的无菌离心管中,弃去底部沉淀;
5) 取出第 0 天所需 10ml 血浆备用;
6) 剩余血浆建议在第3天补液前进行3次-80℃ ~ 37℃环境的反复冻融;3次冻融后1200g, 离心 15min;弃去底部沉淀,于 4℃保存离心后的灭活血浆。(此步骤目的为尽量多的去除 血浆中残留的纤维蛋白原,客户可根据自身需求选择性进行。)
3. P/CBMC 洗涤:用吸管吸取 P/CBMC 细胞层至 50ml 离心管中,为尽量获得更多细胞,建议隔片以上部分全部吸取,注意不要吸到红细胞。在 P/CBMC 离心管中加入 PBS 混匀(PBS 与 P/CBMC 体积至少为 1:1,或加入的 PBS 体积大于 P/CBMC 体积),600g,离心 10min。 弃去上清,加入 PBS 重悬洗涤,300g,离心 10min。 操作注意: 细胞每一次洗涤都会有相应损失,请客户酌情处理。离心有两种损失,第一种是机械损伤细 胞,第二种是离心后上清液中有悬浮细胞。损失量约在 5%-15%之间,建议第一次洗涤前进 行细胞计数,如细胞数量过少,则酌情减少洗涤次数,但至少要洗涤 1 次。 4. 分离出的 P/CBMC 用未加入任何因子的基础培养基 配制成细胞悬液 50ml,加入一 整支“NK-1”,将上述所有液体转移至 T175 培养瓶中,加入 10ml 灭活血浆,置于饱 和湿度、37℃、5.0% CO2培养箱中培养,期间不要移动培养瓶。 操作注意: 1. 建议接种前计数,记录 P/CBMC 投入数量,以便后续实验步骤的分析调整; 2. P/CBMC 建议接种密度为 1.5-3×10 6个/ml,如分离后细胞数少,则相对应减少培养基的 量,但血浆及活化因子添加量不变; 3. 培养期间培养瓶盖需拧松至可透气且不掉落的状态,约 0.5-1 圈(无论使用的是否为透 气瓶,均拧松瓶盖。) 4. 建议使用纯度为 99.99% CO2气体。
第 3 天: 加入 50ml 活化培养基,加入 5ml 灭活血浆。
第 5 天: 加入 100ml 活化培养基,加入 5ml(少于 5ml 则全部加入)灭活血浆。(放入培养 箱时,将培养瓶口垫高,至液体不会从瓶口溢出并拧松培养瓶盖)
第 7 天:(开始计数) 将培养瓶中贴壁的细胞充分吹打下来,转移到 1 个细胞培养袋内(产品货号:N2500TBD) 加入 5ml 灭活血浆(少于 5ml 则全部加入),视细胞生长状态(计数),建议向培养 袋补加 300ml 活化培养基。 第 9 天: 视细胞生长状态(计数),建议向培养袋补加 500ml 增殖培养基,加入剩余灭活血浆。
请客户于培养的第 7 天及后续补液日仔细阅读以下操作释义:
一. NK 细胞培养中判断补液的标准是周期还是浓度:
NK 培养一般来说是按照浓度进行补液,由于个体差异问题,每个样本生长状况不可能 100%相同,按照天数来补液会有一些不准确,所以按照浓度是相对稳妥的。添加培养基的时 间不一定要严格按照后期时间进行,根据具体情况具体分析,确保细胞已经活化成功,呈现 聚团生长的情况,细胞数量有增殖。在补加培养基后,脐带血/外周血细胞密度至少维持在 1-2×10 6个/ml,有利于细胞的生长。
二. 关于培养密度及何时补液的问题: 1. 脐带血/外周血 NK 细胞培养的最佳密度为 100 万个/ml~300 万个/ml。 2. 当细胞密度增殖到 200 万-300 万个/ml 之间,根据公式:当前细胞总量(单位个)÷ 100 万个 - 现有体积(ml)= 本次需补加培养基体积(ml),将补液后的细胞密度控制在 100-200 万个/ml。一般每隔 48 小时计数补液一次,直到培养基完全用光。
3. 如计数后发现当前细胞密度达不到 200 万个/ml,建议 48 小时后再计数,细胞状态不好 或有凋亡现象,立即补加 5ml 灭活人脐带血血浆。
三. 关于 NK 细胞在培养过程中的结团问题: 1. 一般情况下,NK 细胞培养期间有结团现象是正常的,由于血浆中有不可避免纤维蛋白存 在,容易造成细胞聚团或呈现絮状。经过反复吹打或摇晃可散开呈小团状为正常现象。 2. 使用的脐带血不够新鲜,有肉眼可见或不可见的凝血现象; 3. 密度过大; 4. 染菌,细胞死亡,纤维相互交缠; 5. 未及时补液,细胞缺乏营养,死细胞抱团。
四. 为什么我的 NK 细胞长的慢甚至不长? 1. NK 细胞占淋巴细胞比例,若低于 5%,细胞呈缓慢生长或停滞增殖状态; 2. 供血人的身体情况是否健康,无急慢性病,无不良生活习惯,无特殊身体状况; 3. 血液新鲜度(以外周血/脐带血离体 4 小时为判断,4 小时内为新鲜,4 小时以上为不新 鲜); 4. 试剂盒、培养液、分离液的保存温度各不相同,请放置在适宜环境下; 5. P/CBMC 投入密度需达标,至少为 100-150 万个/ml,推荐为 150 万-300 万个/ml 之间; 6. 补液时机准确,培养液呈现橘色,且计数达标后进行补液,过早或过多补液都会造成细 胞不增殖或者少增殖; 7. 接种前 3 天,不要移动培养瓶; 8. 培养环境要稳定,温湿度适宜,CO2气体纯度 99.99%最佳,非必要不反复开关门。 9. 不论使用的是否为透气培养瓶,都要拧松瓶盖进行气体交换,只依靠透气膜的交换是远 远不够的。
第 11 天:
视细胞生长状态(计数),建议补加增殖培养基 500ml。
第 13 天:
视细胞生长状态(计数),建议补加增殖培养基 500ml。此时取样做细菌、真菌、支原体、 内毒素检测。
第 15 天:
视细胞生长状态(计数),建议补加增殖培养基 500ml。
第 17 天:
收集 NK 细胞悬液 2500ml,400g×10min 离心后弃去上清液,250ml 离心管集 2 管每管生理 盐水 200ml 洗涤(1500rpm×8min)1 次,再用 50ml 离心管生理盐水 100ml 洗涤(400g×10min) 1 次,按照 200ml 生理盐水+ 8ml 20%人血清白蛋白重悬细胞,封装好后送至使用部门,同 时留样封存以备日后检测。
【 注 意 事 项 】 1. 使用前请仔细阅读本试剂盒说明书,并严格按照说明书执行操作。 2. 本试剂盒必须按规定温度保存,不可反复冻融。试剂在使用前需常温解冻,并充分混匀, 不可剧烈震荡。 3. 可视细胞生长的实际状况适当调整补液时间和用量。