摘要
提出了一种同时优化多种细胞培养基成分的新的高通量方法。该方法基于培养基混合方法,该方法在处理即用培养基时具有几个优点。特别是,它可以精确调节pH和渗透压,并消除了对浓缩储备溶液的需要,避免了溶解度难容的问题。此外,培养基混合容易产生大量新的组合物,提供了一个显著的筛选工具。然而,培养基混合设计通常不提供关于引起所需改进的不同因素或成分的信息。本文通过考虑单个培养基组分的浓度来解决最后一点,以确定实验设计并解释结果。在一轮实验中,使用扩充混合策略对20种氨基酸进行重组。专门设计了一小组10种培养基来产生大量混合物。然后通过培养基混合制备192种混合物,并在表达单克隆抗体的重组CHO细胞系上进行测试。从不同的混合物中获得了广泛的性能(滴度和活细胞密度),最高滴度显著高于我们之前在该细胞系中看到的结果。此外,可以从实验结果中提取关于关键氨基酸对细胞密度和滴度的主要影响的信息。这表明,扩充混合方法是一种强大的实验工具,可以系统地同时重组多种培养基成分。介绍
哺乳动物细胞已成为制药工业生产重组蛋白的首选宿主。在过去的20年中,通过工艺和培养基的优化,重组蛋白的滴度(g/L)得到了显著的提高。进一步的提高仍然是可能的,对于吨/年规模的工业蛋白质生产来说,显然需要这样做。许多培养基成分已被证明是细胞生长和/或生产力的限制因素,并且它们的浓度已显著增加。细胞培养基的优化对于提高生物工艺的产率至关重要。它可以在克隆选择后、关键临床试验前或作为改进通用培养基的通用方法。除了生产力,细胞培养基已被证明对蛋白质质量有影响。Gawlitzek等人已经证明,例如,培养基组分对重组蛋白糖型有影响。因此,理解培养基组成和蛋白质表达/质量之间的关系是通过设计制造工艺来提高工艺知识和实现质量的关键。实现培养基优化并了解哪些成分对工艺有影响是一项具有挑战性的任务,细胞培养基含有50-100种成分。已经提出了开发和改进培养基的不同策略。最著名的方法是一次一个因素(OFAT)策略,其中除一个成分外的所有因素都保持不变。尽管这是最简单的系统方法,但它很耗时。此外,在确定几个组件的最佳组合时,它受到了严重的限制,因为它无法考虑组分之间的相互作用。这种相互作用在复杂的代谢途径中普遍存在,在培养基优化中需要特别注意。在因子设计中,几种成分的浓度同时变化,因此代表了识别相互作用和寻找成分最佳组合的选择方法。因子设计已被用作细菌系统和哺乳动物细胞如CHO细胞的培养基开发工具。析因设计的一个缺点是需要大量的实验来测试合理数量的因子。为了在全析因设计中测试六个单独的培养基成分,需要64个实验。考虑到工作量和人为错误的风险,如果手动启动实验,32-64种不同的条件代表了上限。这可以通过使用自动机械来避免,例如自动化的96 deepwell细胞培养平台,该平台允许每次实验筛选96个(或多个)条件。然而,在析因实验中增加成分的数量是有问题的,因为它们是作为储备溶液添加的。一方面,添加的储备溶液的数量越高,原始成分的稀释度就越高,另一方面,加入的体积越小,储备溶液的浓度就越高。对于目前富含氨基酸和维生素的培养基,这会导致严重的溶解度问题。已经提出了各种替代方法来优化培养基,如代谢通量分析、消耗研究和混料设计。混料设计被证明适用于鉴定最佳培养基混合物。还使用混料设计来确定三种关键成分的最佳混合物,同时保持所有其他所需物质不变。混料设计是可行的,因为不存在组分溶解度或培养基稀释的问题。此外,在高通量细胞培养平台上进行的培养基混合允许进行大量实验。从历史上看,培养基混合经常被用作从实验室中可用的培养基中生成不同混合物的快速方法。这些混合物可以被鉴定为新的培养基,因为它们具有不同于原始母体培养基的独特组成。在许多情况下,混合培养基的性能将超过任何原始母体培养基。使用具有改进性能的两种或多种现有培养基的混合物的这种方法的一个好例子是DMEM/F12培养基,其经常用作进一步优化的初始基础培养基。然而,到目前为止,观察到的这种混合物的性能不能与单个培养基组分联系起来。在本文中,要混合的培养基的成分经过了专门设计,以获得此类附加信息。应用合理混合培养基的方法来评估不同浓度的20种氨基酸对单克隆抗体滴度和细胞生长的影响。本文描述了生成高质量数据集的新方法,该数据集可进一步用于培养基优化。材料和方法
培养基配方的设计和制备
基于DMEM/F12组分并补充胰岛素、F-68和微量元素的专有培养基配方通过培养基混合得到进一步改进。此前,最初的DMEM/F12配方通过析因设计进行了几轮优化,得到了强化培养基。面对高浓度氨基酸的溶解度问题,最新的分数析因设计测试了10多个因子,主要集中在维生素和微量元素上。在对这些成分进行了几次测试后,假设它们不再是我们富集培养基的限制因素。因此,下一轮的重点是20种氨基酸:所有氨基酸都是可变成分,而其余成分保持不变。所有可变成分的形式分布如表1所示。氨基酸的具体浓度是根据以下几点选择的:(a)先前析因测试的结果和观察结果(b)实际消耗率(c)氨基酸的化学性质。对于大多数氨基酸,所选浓度符合以下标准:0接近DMEM/F12中的浓度,1是先前优化的浓度,2是1浓度的两倍。对于含有2所有成分的配方,所有氨基酸的总浓度将达到143mM。由于每个配方还含有0的几种氨基酸,实际总和约为70mM。一旦设定了所有氨基酸的水平,就根据表1制作了10种不同的配方。表1:描述10种不同培养基配方(F1-F10)组分的模型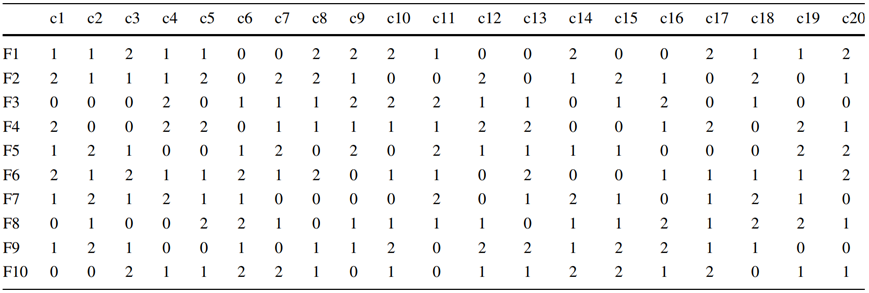
该模型只考虑不同配方中可变的成分。虽然在本文中组分c1-c20对应于20种氨基酸,但c1-c20也可以包括任何其他组分。0、1或2表示相对浓度,每个成分的绝对值可能不同。
这10种不同的培养基是通过对各个组分进行称重而从头开始制备的。在最后加入NaCl以将培养基渗透压调节至320mOsm。10种配方的最终组成对应于先前富集的专有培养基,除了20个氨基酸。过滤除菌后,立即使用所有培养基或在2–8℃下储存最多3个月。自动培养基混合
在液体处理工作站上进行高通量培养基混合。表2显示了一些混合说明和作为实例的所得混合物。将192种混合物直接混合到两个96深孔板中。自动化可以在大约2小时内完成这项任务。培养基中15mM HEPES的存在将这段时间内的pH漂移限制在可接受的值。手动混合一些混合物,以便在振荡的50mL摇管中进行对照实验。表2:混合配方(a:B1-B192)和由10种配方F1-F10产生的后续混合物(b:M1-M192)(见表1)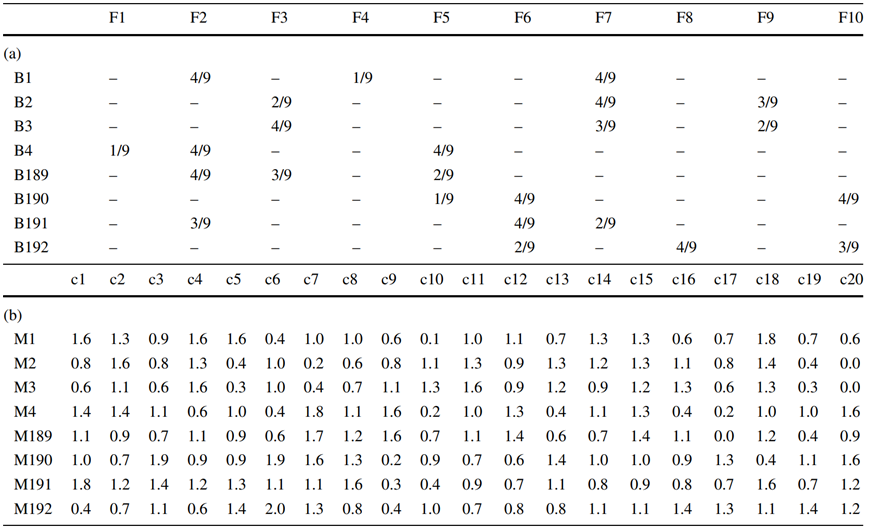
细胞培养
对于所有实验,使用产生单克隆抗体(IgG)的重组中国仓鼠卵巢(CHO)细胞系。使用含有基础培养基的50mL管中培养细胞。在启动实验之前,通过在200g下10分钟的短暂离心步骤来交换培养基。将细胞与所有测试组分以107个活细胞/mL的细胞密度在0水平下重新悬浮在基础培养基中。将该浓缩的细胞池直接稀释到192种培养基配方中,最终密度为106个活细胞/mL。将96孔板在ISF-1摇床上培养长达2周的时间。样品分析
在第6天、第10天和第13天采集样本。测量细胞密度和IgG滴度。培养基混合的混料设计方法
培养基混合是改进细胞培养基的一种既定方法。提供混料设计模板的多个软件,包括用于统计数据分析的所有相应工具,可在市场上买到。混合物可以包含2种、3种或更多种母体培养基配方。3种不同培养基配方(F1、F2和F3)的混合物示例如图1a所示。这种经典方法适用于确定更好的配方,尽管它没有解释为什么混合物表现得更好。图1a中示例的更正式的描述在图1b的第一部分中表示为“混料模型”。为了将结果与特定培养基成分相关联,并开发数据分析和解释,必须扩充该模型:首先考虑母体培养基或配方的成分,其次考虑所得混合物的新成分。配方上,如图1b所示,“配方模型”和“混料模型”被添加到“混料模型中”。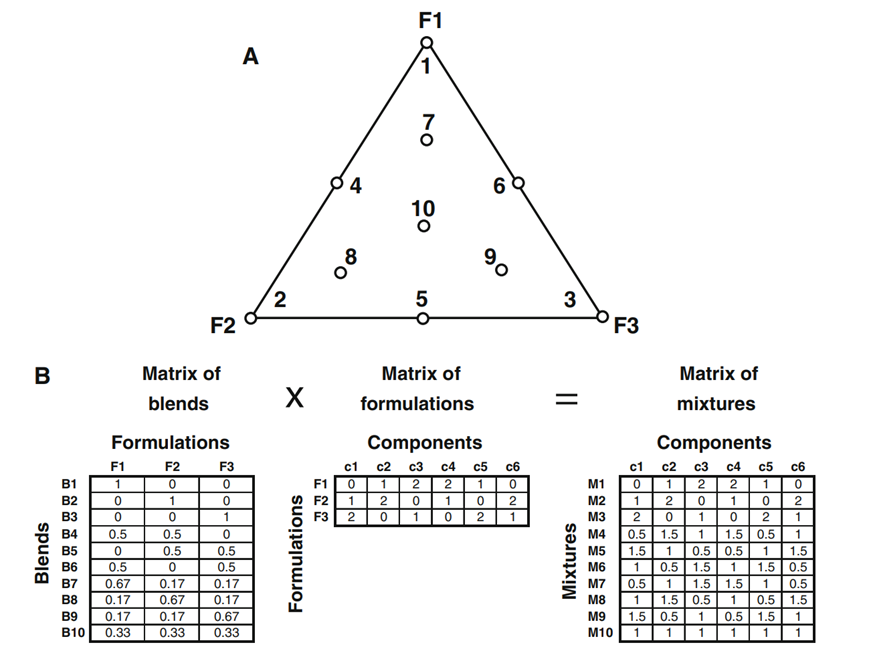
图1:三种不同母体培养基配方(F1、F2和F3)的基本混合物设计及其扩充。代表纯配方(1、2和3)、对称二元混合物(4、5和6)、不对称三元混合物(7、8和9)和对称三元混合物的经典混合物设计。b将基本混合物设计正式表示为“混料模型”,并通过另外两个模型对该设计进行扩充:一个“配方模型”描述含有组分c1–c6的培养基配方F1、F2和F3,另一个“混料模型”描述组分c1-c6的混合物M1–M10的确切组成。
据我们所知,这种扩充还没有被报道用于培养基混料实验。一个主要原因可能是,在这种扩充合理之前,需要满足几个条件:主要的成分必须在不同的培养基中是可变的,培养基组成必须是已知的,可变成分的数量应该是现实的。通过直接从市场上选择培养基,人们几乎无法控制实际的成分。在某些情况下,几乎所有成分的浓度都不同(例如,DMEM和F12培养基),而其他培养基仅在少数成分上不同。相反,本研究使用了一小组专门设计的培养基,其中的成分要么固定在所需的浓度,要么系统地改变每种培养基配方。为了证明扩充培养基混料概念的可行性,组分的变化仅限于不同的氨基酸。理想情况下,这20个可变成分应该相互完全独立地进行研究。但在这种情况下,至少应该从头开始设计和制备21种不同的培养基配方——这个数字超过了我们的培养基制备能力。作为一种折衷方案,在该项目开始时,将从头开始制备的培养基配方的数量固定为10个。即使这个数字已经处于典型混料实验中使用的上限——它允许产生大量新的混合物——但显然不足以优化20种不同的成分。意识到这一限制,考虑到新设计将不可避免地导致某些成分之间的一些相关性,这可能会导致变量之间的混淆效应。考虑到混杂变量对统计分析的负面影响,最大限度地减少10种培养基中变量成分之间的相关性具有最高的优先级。这10种培养基的设计比最初预期的要困难得多。如何固定10种培养基中20种成分的浓度的可能性可能是无限的,但只有特定的组合才能代表合适的“配方模型”。找到最佳模型是一个尚未解决的挑战。由于在文献中没有找到合适的模板,因此建立了一个定制的模型。对于所有培养基配方F1-F10,根据经验将0、1或2的标准化浓度水平分配给每个单个氨基酸。在10种配方中,每种成分的水平0和2恰好出现3次。此外,“配方模型”各成分之间的相关性被用作主要的限制性标准(R2被限制为<0.3)。经过几轮迭代改进后获得的最终设计如表1所示。在这10种配方中,氨基酸被充分搅匀,并且每种配方都包含这些成分的独特组合。下一步是定义混合配方或“混合模型”。该模型必须符合“配方模型”。表2中给出了一些最终混料设计的例子。混料设计专门针对三元混合物。出于实际原因,混料设计和混合比适用于自动平台,当两个96孔板的混合物与9个馏分混合时,自动平台开始工作。此外,希望在几个不同的水平上测试每个组分。将9种组分的不对称混合物应用于10种培养基配方中,在得到的192种混合物中,每种组分产生19种不同水平(浓度)。含有不同水平组分c1的混合物的确切数量如图2a所示。所有其他成分的频率分布相似(数据未显示)。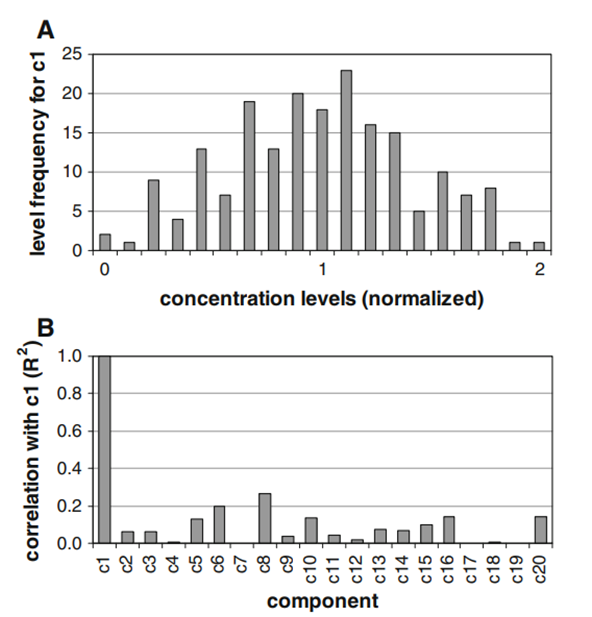
图2 :192种混合物的完整集合的统计评估。a不同混合物中组分c1的相对浓度分布图。虽然在0和2之间的许多额外水平是由不对称的三元混合物产生的,但最常见的水平接近发生18次的水平1。b c1与最终混合物的可变成分之间的相关性。
所有图谱都显示了一个相当保守的水平分布,最大频率在1附近。这样的分布应该确保只有少数成分同时被改变,而其他成分则被适度调整,接近1。改变成分的浓度当然可以改善培养基,但也存在获得性能较差的成分的潜在风险:较低的浓度(0)可能会造成限制,而较高的浓度(2)可能具有抑制性或毒性。当过多的组分同时出现在这种非最佳浓度下时,新混合物表现良好的机会将大大降低。因此,所提出的设计避免了任何混合物在最低或最高水平含有一种以上的成分。如表2b所示,M192含有一种2成分(c6),而所有其他成分分布在0.4至1.4之间。良好的混合和配方设计最大限度地减少了最终混合物中成分之间的相关性。我们的最终设计是通过计算“混料模型”中出现的所有相关性进行检查的。c1与其他成分的相关性如图2b中的代表性示例所示。与其他变量分量的大多数相关性(R2)低于0.2的值。混合变量的数量是可以接受的,其影响是有限的。在c1的情况下,只有c8具有高于0.2的相关性。结果和讨论
培养基混合实验结果
在本研究中,将10种含有不同浓度的20种氨基酸(c1-c20)的母体培养基混合,获得192种不同的混合物。以各种组合和比例混合这10种配方改变了可变成分(氨基酸)的浓度,但对其他培养基成分没有影响。这种同时在多种浓度下稀释20种氨基酸的方法旨在改善内部培养基。事实上,这种方法是成功的,近一半的混合物的性能优于目前的培养基。这里显示并讨论了一些有代表性的结果。最相关的参数,即培养第13天的最终IgG滴度,范围为50至2400 mg/L(图3a),表明蛋白质表达与氨基酸组分密切相关。在更详细地分析大数据集之前,验证了96孔板结果的可预测性。为此,选择两种混合物,性能最好的M27和性能较低的M86,并在50mL管中培养。所选混合物的操作非常简单(根据原始混合说明,手动混合最多3种特定培养基配方)。在大型混合实验中获得的滴度可以在第二次测试中确定(图3b)。这些结果之间的一致性表明,图2a中显示的滴度变化不是由实验噪声引起的。因此,滴度的差异与氨基酸的组成和平衡有关。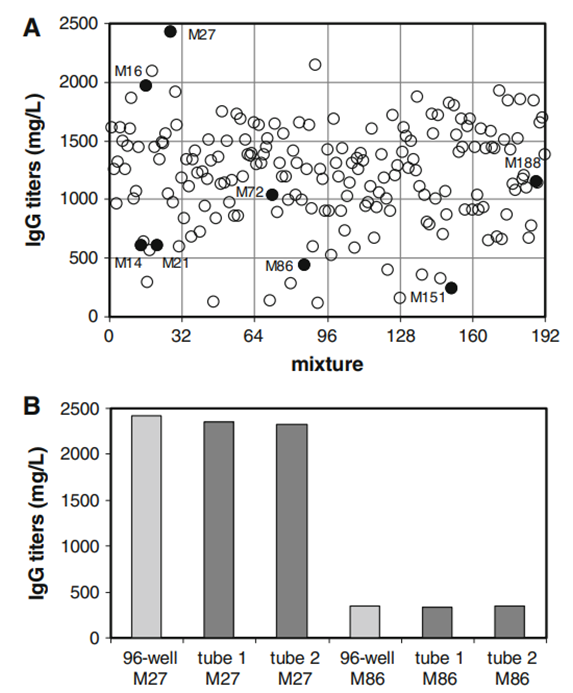
图3:分批培养13天后测量的最终滴度。a所有192种混合物的IgG浓度概述。完整的符号有助于识别本图和下图中选定的混合物。b在50 mL管中对性能最佳的混合物(M27)和性能较低的混合物(M86)进行滴定确认。
预期第6天的活细胞计数是用于评估培养基组分对细胞生长的影响的合适指标。在这一点上,培养物应该已经达到最大细胞密度。对于初始培养基,通常没有观察到细胞数量的进一步增加,但细胞在接下来的几天内保持了良好的活率(数据未显示)。在第6天,几种混合物培养的细胞密度为800-1100万个细胞/mL(图4a)。其他混合物产生相当低的细胞密度,表明生长抑制或由于必需成分耗尽而受到限制。尽管高产品滴度通常与良好的细胞生长有关,但在某些情况下,细胞生长必须与最大滴度相平衡,正如M27混合物产生最高最终IgG滴度所观察到的那样。在第6天,该混合物的细胞密度为5×106个细胞/mL,该值明显低于大多数其他混合物。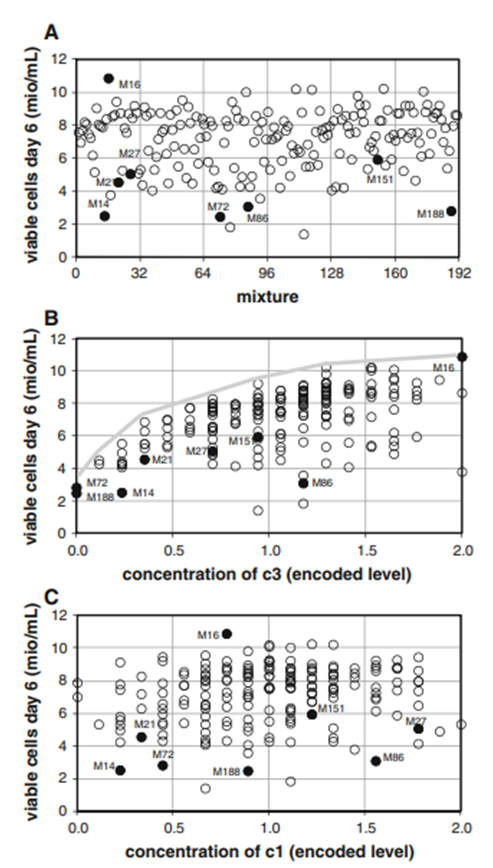
图4:第6天在192种混合物中获得的活细胞密度。a在不考虑关于组分浓度的信息的情况下,对所有混合物测量的活细胞数的概述。活细胞数相对于编码浓度c3(b)和c1(c)作图。
将影响归因于单因素组分
该项目开发和测试的模型基本上与图1b中的模型等效,只是它们更大。本文中描述的“混料模型”在混料实验中通常被忽略。然而,这样的模型对于任何进一步的详细数据分析都是至关重要的,因为它描述了每种混合物的确切组成。一旦已知不同的组成,就可以根据活细胞计数或IgG滴度绘制可变成分的浓度。通过对所有氨基酸进行系统的研究,可以识别关键成分,并将主要影响归因于少数氨基酸。天冬酰胺(c3)被发现对细胞生长有很强的影响(图4b)。尽管在1.3和更高的相对水平下获得了每毫升107个细胞,但在较低的c3浓度(0和1之间的水平)下没有实现这样的密度。对于含有最低c3浓度的两种混合物M72和M188,获得的细胞数小于3×106个/mL。由于对于这两种特定的混合物,所有其他氨基酸都以中等浓度存在,因此细胞生长不良很可能是由低c3浓度引起的。c3也被怀疑是其他几种混合物中的主要限制因素,特别是低于约1的水平。灰色线强调了潜在的限制(图4b)。灰色线上方数据点的缺失表明c3是该细胞系的主要限制因素。尽管有多种迹象表明c3存在局限性,但c3浓度与活细胞数量之间的相关性相当弱(线性测定系数R2=0.26)。如此低的系数似乎与c3对细胞生长的强烈影响形成了对比。然而,必须考虑的是,许多混合物含有浓度有限的其他氨基酸。对于这些混合物,由于c3不再是主要的限制因素,因此预计c3不会与细胞数量相关。一些成分在测试范围内没有明显影响。丙氨酸(c1)的图谱说明了这样一种情况:c1对细胞生长几乎没有影响(图4c)。c1的曲线图与c3的曲线图很好地区分开来,因为无论c1的浓度是多少,都会达到最大细胞浓度。这两个例子表明,尽管组分之间的相关性很弱,但非正交设计对于并行测试许多组分仍然有用。另一个关键成分是酪氨酸(c19)。这个组分代表了一个有趣的案例,因为它的效果很大程度上取决于所分析的响应。关于细胞生长(图5a),c19在水平1以上可能是负的,而在低浓度下它只是一个弱的限制因子。在相对水平0下,M151混合物每毫升产生6×106个细胞,这仍然可以被认为是一个合理的数字。关于滴度(图5b),M151混合物远低于其他处理获得的性能,IgG低于300mg/L。高达0.5的水平,组分c19似乎是IgG产生的强大限制因素。在1.1水平上获得了最高滴度,这表明c19在该浓度下不再是限制因素。从这些数据来看,尚不清楚超过该值的浓度是否会因对细胞生长的潜在负面影响而导致滴度降低。需要更多的实验来解决这个问题。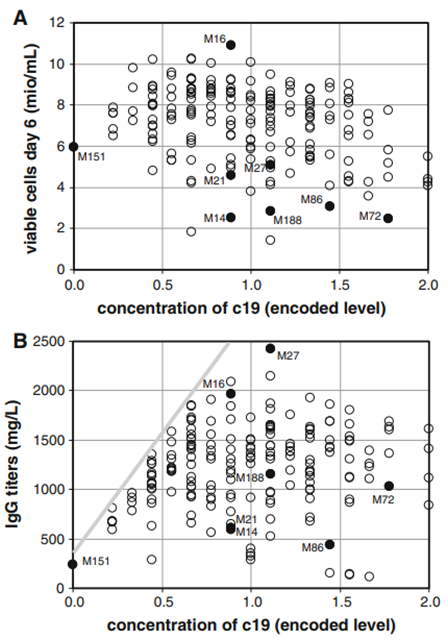
图5:与c19浓度相关的对细胞生长和产物滴度的不同影响。a第6天的活细胞密度。b第13天的IgG滴度。
对未来设计的探讨与展望
我们在这里提出了一种扩展的混合方法,它具有几个实际优势,因为它的执行简单明了。虽然我们将该方法形式化,并证明了该概念效果良好,但我们意识到,没有任何数学模型和软件可用于设计和分析这类实验。通过培养基混合,20种氨基酸在多种浓度下同时被稀释,形成了一个信息丰富的大型数据集。虽然多元分析(MVA)是一种非常好的方法,可以分析具有许多变量和响应的大型数据集,但这种统计工具并没有为我们特定类型的数据分析提供真正的附加值。MVA的主要问题是,对于每个变量都存在几个混合因素。变量之间的弱相关性极大地减少了MVA的应用。没有任何相关性的设计是可行的,文献中已经描述了例子。例如,Plackett和Burman提出了一种很好的正交设计,允许用户将19种不同的成分分配到20种母液培养基中。然而,避免任何相关性会导致其他限制:这种设计将母液培养基的数量增加了一倍,并导致最终浓度范围缩小,因为浓度仅设置在两个水平。或者,可以采用具有三个不同水平的组分的正交设计,但这将进一步增加母液培养基的数量:16个组分的正交设计将需要36个培养基。我们的系统混合方法应适用于其他理想的培养基成分,而不限于化学成分限定的培养基。事实上,任何培养基,包括含有未确定成分(如血清或水解物)的培养基和成分未知的培养基,都可以通过这种方法进行评估。在没有公开成分浓度的情况下,变量的水平0的绝对值是未知的。然而,只要可以将所需的成分添加到培养基中以获得1水平和2水平,测试和解释就应该是可能的。更复杂的设计(例如,更大的培养基配方、更多的成分和降低的相关性)应该是可能的。最终,可变组分的模板可能会扩展到所有培养基组分。这将允许用户通过合理的高通量实验在一次实验中对所有组分进行筛选。这种方法可以应用于新的重组细胞克隆,以便获得有关单个克隆的真正潜力的早期信息,并确定特定克隆优化所需的成分。总之,改进的混料设计拓宽了培养基筛选/优化的可能性。培养基混合是一种有效的工具,可以同时筛选和稀释多种成分,而无需浓缩原液。利用这种方法生成的数据可以被分析并用于进一步的优化。虽然在目前的研究中,细胞密度和滴度是研究重点,但通过更大的分析小组,可以包括其他质量属性,如糖基化、脱酰胺、聚集、甲硫氨酸氧化、C末端赖氨酸的断裂和缺失,以使培养基适应特定分子。合理的培养基混合是一种很有前途的方法,可以快速识别重新平衡的高性能培养基成分,并有可能提供有关单个关键成分最重要影响的有效信息。
以上文章来源于Cell Culture
关于宥艺生物
上海宥艺生物科技有限公司是一家专注于提供化学成分限定商业化培养基、客户定制化培养基的研发及生产,培养基配方开发及优化服务的高科技生物技术公司。涵盖CHO细胞培养基、HEK293培养基、Vero细胞培养基、昆虫细胞培养基、杂交瘤培养基,T及NK细胞培养基和干细胞培养基等。致力于解决未被满足的培养基市场需求及拓展培养基应用领域,经过2年的研发已经建立完善的6大培养基产品线:
关注宥艺生物微信公众号:欢迎咨询宥艺产品,宥艺生物将免费提供测试产品。
网址:www.youyimedium.com
邮箱:bd@youyimedium.com
联系电话:18193664815








