摘要
Vero细胞系被认为是生产病毒载体和疫苗最常用的连续细胞系。从历史上看,它是第一个被WTO批准用于生产人疫苗的细胞系。关于使用Vero细胞系生产许多病毒的综合实验数据可以在文献中找到。然而,这些工艺中的绝大多数都依赖于微载体技术。虽然这一系统是为大规模生产病毒疫苗而建立的,但它仍然相当复杂和劳动量大。此外,放大仍然很困难,并且受到载体的表面积的限制。为了克服这些缺点,并建立更高效的生产工艺,当务之急是通过应用新型生物工艺技术进一步开发Vero细胞平台。特别是在当病毒大流行的时代,先进和可放大的平台技术可以提供更高效和更具成本效益的解决方案,以满足全球疫苗需求。在此,我们回顾了用于生产病毒载体和疫苗的Vero细胞生物工艺开发的主流文献,旨在评估生物工艺开发方面的最新进展。并描述了利用细胞培养工程领域的最新发展来改进Vero细胞平台的瓶颈。
介绍
疫苗被认为是预防和控制传染病传播的最有效方法。传染病的主要来源之一是病毒。目前,研究发现新疫苗或开发和改进现有的病毒性疾病疫苗是世界范围的高度优先事项。在这一领域,基于细胞培养的病毒载体和疫苗的生产正越来越受到关注,这是因为有一种趋势,即不再采用既定的生产策略,如在鸡蛋或原代细胞系中生产。基于细胞培养的生产工艺的优点包括独立于鸡蛋的供应,以及最大限度地减少交叉污染或过敏反应。此外,使用规定的无血清细胞培养基可以实现更一致的工艺。此外,细胞培养物可以适用于涉及生物反应器的制造过程,这些生物反应器是可放大的,需要更少的空间,并且其中可以采用过程分析技术来监测生产并将过程控制维持在定义的参数内。此外,这允许更快速的生产,尤其是在急需疫苗的流行病时期。值得注意的是,Vero细胞系是WTO批准的第一个连续细胞系(CCL),用于根据特定的监管指南生产供人类使用的病毒疫苗(世界卫生组织,1987a1987b)。Vero细胞在低于一定传代数时被认为是非肿瘤性的,并且可以安全地用作疫苗的生产。关于Vero作为疫苗生产细胞系的建立和WTO批准的细胞库的创建,可以在其他地方找到。这种细胞系是在1962年从一只非洲绿猴的肾脏中提取的细胞中建立的。此后,已经衍生出几种亚细胞系,例如Vero 81、Vero 76或Vero E6。后来的基因组分析表明,这些细胞来源于一只雌性的黑脸绿猴。Vero细胞系是一种连续的细胞系,因此它可以无限期传代,从而实现广泛的细胞表征和大量细胞库的建立,这与传代能力有限的原代细胞系(如鸡胚成纤维细胞)相比是一个宝贵的优势。Vero细胞贴壁生长,干扰素表达不足,可以适应在无血清条件下生长。它们被广泛应用于许多研究领域,特别是病毒学、细菌学、寄生虫学和毒理学。Vero细胞易受多种病毒感染。其中一个原因被认为是其干扰素表达不足。细胞在感染病毒时不会分泌信号肽干扰素,因此细胞的抗病毒防御机制受损。可在该细胞系中增殖的病毒的实例列于表1中。
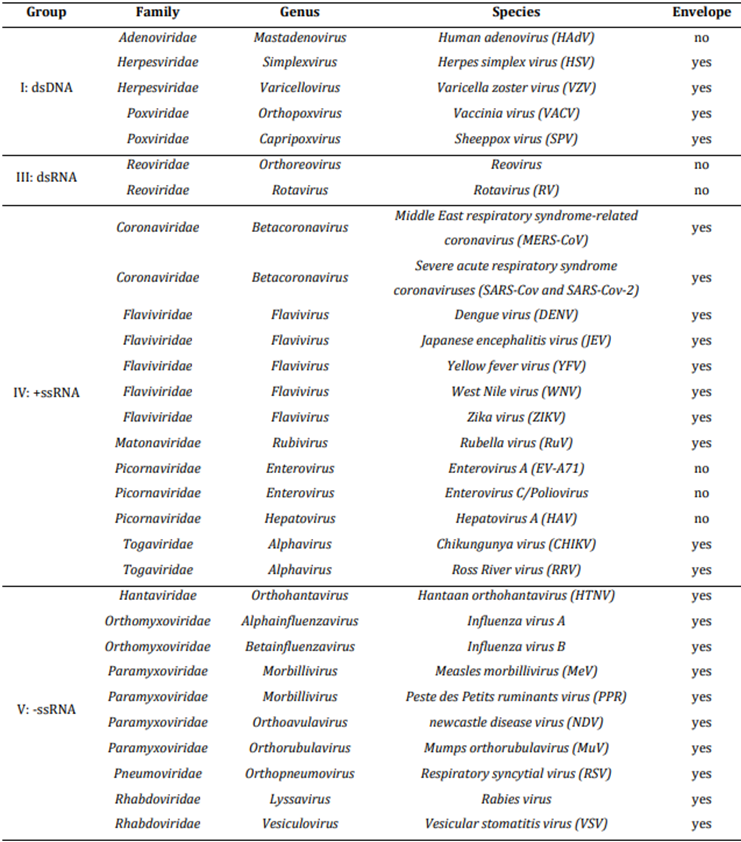
从历史上看,这种广泛的易感性导致了基于Vero细胞中产生的相应致病病毒的疫苗的开发,包括全灭活病毒疫苗或减毒活病毒疫苗等疫苗类型。这一特性使Vero细胞系成为开发新型病毒性疾病疫苗的宿主。已经开发了几种使用Vero细胞生产多种疫苗和候选疫苗的工艺。如表2所示,迄今已有几种基于Vero细胞的疫苗上市。
表2:已上市的基于Vero细胞的疫苗
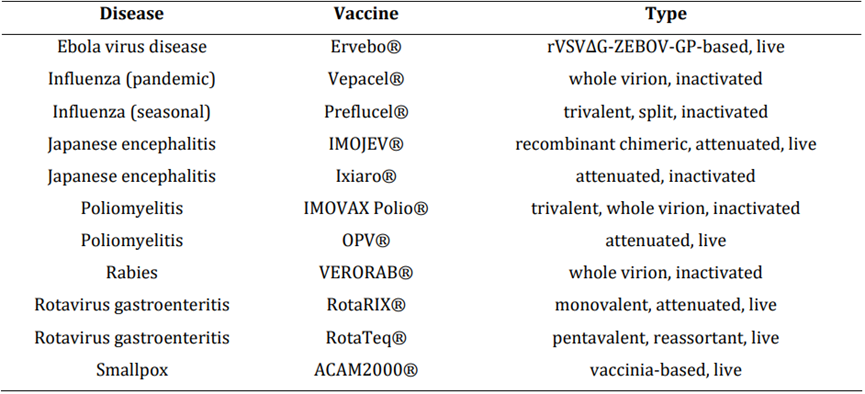
可应用于Vero细胞系的新型病毒疫苗平台的一个实例是基于水泡性口腔炎病毒(VSV)。使用这种病毒的重组株(rVSV),其中天然表面糖蛋白(VSV-G)已被另一种病毒的表面糖蛋白取代,可以以更安全的方式将其他病毒的抗原给予人类。对于致病病毒在细胞培养中不能很好复制的情况,或者生物安全标准和方案过于严格,无法有效开发大规模生物工艺的情况,这一点尤其令人感兴趣。作为这种新型重组疫苗平台的一个例子,最近批准的埃博拉病毒疾病疫苗基于表达扎伊尔埃博拉病毒糖蛋白(rVSV-ZEBOV)并在Vero细胞中产生的rVSV。此外,针对获得性免疫缺陷综合征(rVSV-HIV)、针对马尔堡病毒病(rVSV MARV)或拉萨热(rVSV-LASV)的疫苗目前正在开发中。然而,基于细胞培养的病毒疫苗生产面临挑战,需要以相对较低的成本生产大量病毒,以满足全球需求,特别是在低收入国家。已上市的全病毒疫苗的剂量范围为106至108个病毒颗粒,例如1×106 CCID50(RotaRIX®)、4.0至6.3×106 pfu(IMOJEV®)或7.2×107 pfu(Ervebo®)。因此,有必要开发高产量的疫苗生产工艺。生物工艺开发和优化策略已被证明可以加强生产,减少生产时间和成本。最近,Vero细胞也被研究作为生产某些溶瘤病毒的细胞基质。与预防传染病的疫苗相反,病毒溶瘤疗法通过溶瘤病毒复制选择性靶向并杀死癌症细胞来对抗癌症。可能在Vero细胞中产生的溶瘤病毒的例子是HAdV、HSV、MeV、呼肠孤病毒、VACV、VSV的菌株。溶瘤病毒生产的主要挑战是,与每剂疫苗所需的量相比,每次治疗对功能性病毒颗粒的需求甚至更大。这一需求可以与基因治疗应用的需求进行比较,通常是疫苗接种的1000多倍。例如,对于基于MeV的系统,一名患者的溶瘤治疗所需的MeV颗粒甚至是一剂疫苗的107-108倍。因此,达到更高的产量对这一新处理技术的实施和建立更为关键。在下文中,这项工作的重点是使用Vero细胞系作为生产病毒载体和疫苗的平台。综述了Vero细胞上游生物工艺的开发,涉及加强病毒生产的当前趋势和策略。
细胞系工程提高细胞特异性病毒生产力
与培养模式无关,需要提高细胞特异性病毒生产力来改善作为底物的Vero细胞系。近年来,已经进行了RNAi和CRISPR筛选,以寻找在敲除或敲除后会增加细胞培养中病毒产生的靶基因。这些研究使用靶向人类基因序列的RNAi或CRISPR文库。迄今为止,为Vero细胞系设计的文库还不存在,并阻碍了对该细胞系的全基因组研究。其中一个障碍是缺乏注释的基因组。Vero基因组的序列草案已经发表,但详细的基因组信息仍然无法获得。在Vero细胞基因组中搜索目的基因序列的另一种方法是参考黑脸绿猴基因组中的相应序列(NCBI组装号:GCF_000409795.2)。然而,由于Vero细胞基因相对于其祖先起源发生了许多变化,遗传工程方法出现了困难,因此需要Vero细胞系的注释的全基因组。例如,在这种情况下,已经对CHO-K1细胞系做出了类似的努力,其中可以容易地应用诸如CRISPR的基因工程工具(NCBI组装号:GCF_000223135.1)。尽管存在这些障碍,一项研究调查了将基因工程应用于Vero细胞系以降低病毒疫苗生产成本的潜力。在人类细胞系中进行了一次全基因组的初步RNAi筛选。在基因敲除后,脊髓灰质炎病毒的产生被证明是增加的。然后在Vero细胞中验证了最高基因命中率,并报告了病毒滴度的显著增加。这些令人兴奋的结果表明了基于细胞的疫苗生产的潜力,并导致了后续研究。与最初的工作类似,这些研究调查了基因敲除或敲除在Vero细胞中增加其他病毒产量的应用。所有这些研究都是在组织培养孔板中小规模进行的。当这项工作放大到T形瓶和微载体培养,并应用于不同的Vero细胞系时,结果无法重复。作者强调了他们在Vero细胞系基因组信息的可用性方面面临的问题。van der Sanden等人的工作中靶向Vero细胞系的RNAi和CRISPR构建体是使用人类基因序列设计的,而Hoeksema等人针对Vero基因组草案设计了gRNA。然而,只有使用靶向人类基因序列的RNAi文库才能验证基因靶点命中率。为了进一步研究这些新的基因工程技术在Vero细胞系中的应用,需要开发工具来进行针对Vero基因组的筛选。此外,为了研究敲除与敲除效应差异的明显问题,一个完整注释的Vero基因组将能够应用转录组学以及下一代测序和基因编辑工具。此外,正在使用不同的Vero菌株,需要一个注释的基因组来比较这些菌株,并解释这些细胞系实验结果的差异。
生产病毒的生物工艺开发
一般来说,基于细胞培养的病毒生产工艺可分为两部分,上游和下游工艺。首先,培养细胞以在细胞扩增阶段产生足够的细胞。然后感染细胞以启动病毒复制阶段。一旦病毒生产完成并达到病毒浓度的峰值,下游工艺就开始于收获培养物。通常,这之后是澄清、病毒灭活、病毒纯化和最终产品制剂的步骤。为了降低总体生产成本,从上游生物工艺开发的角度来看,目标是建立一种具有优化病毒生产力的工艺。鉴于此,一个指导原则是,作为底物的细胞越多,就可以产生越多的病毒。此外,其目的是保持细胞处于产生病毒的最佳生理状态。因此,上游工艺开发的主要目标是产生尽可能多的细胞,同时将细胞保持在最佳病毒生产力的状态。这可以通过优化感染时间(TOI)来实现,并且过程控制负责维持对细胞生长和活率重要的最佳条件。工艺参数的例子有温度、pH、溶解氧、渗透压、剪切应力和营养供应。病毒的产生始于培养物的感染,这是通过在预先确定的感染倍数(MOI)下添加定量的病毒储备溶液来进行的,MOI是在TOI下每个细胞的病毒颗粒的比率。病毒附着和进入细胞是关键的一步。这取决于细胞与病毒相互作用的特定性质,可能需要额外的工艺变化,如降低pH值、降低温度或改变搅拌速率。然后,在复制阶段,宿主细胞被接管用于生产病毒颗粒,最佳的工艺条件对于生产尽可能高质量的产品仍然至关重要。一旦细胞内病毒复制完成,核酸、氨基酸和细胞膜等将被耗尽,最终导致细胞死亡并结束上游工艺。Vero细胞通常是贴壁生长的。因此,需要实施适应贴壁培养的生物工艺。形成贴壁过程的初始阶段通常在细胞培养孔板和T型瓶中进行。这些培养物在静态培养箱中培养,并控制温度、CO2水平和湿度。传代时,细胞需要从表面分离,这通常是使用酶溶液如胰蛋白酶进行的。分离后,将细胞离心,重悬于新鲜培养基中,并接种在新的容器中。可以在显微镜下观察这些小规模培养物,以检查细胞并监测细胞生长。此外,交换培养基很容易,并且可以同时测试多种条件以达到优化目的。为了增加细胞的数量,通过增加表面积来扩大规模,使用更大的T型瓶、多层系统或滚瓶。然而,在更大的规模下或同时处理多个容器时,细胞传代和病毒收获可能会变得相当费力。此外,过程监测和控制的选择非常有限。尽管如此,这些技术仍在用于生产成熟的疫苗,或用于大规模系统的细胞底物生成的部分种子序列。近年来,已经开发了新型固定床生物反应器系统,以进一步增加贴壁细胞生长的可用表面积,并应对工艺开发挑战,即扩大规模。在这里,细胞粘附在密集堆积的支持基质上。然后将培养液泵送通过固定床以向细胞提供氧气和营养。结果,细胞不像在搅拌槽生物反应器中那样与在通气过程中出现的气泡接触。与来自叶轮的搅拌引起的剪切应力相比,在固定床内剪切应力减小并且可忽略不计。灌流应用不需要细胞截留系统,并且消除了这种过滤器的污染风险。有许多类型的固定床生物反应器系统,到目前为止还没有一种系统占主导地位。例如,Vero细胞已在填充Fibra Cel®圆盘、填充床BelloCell振荡生物反应器、iCellis®生物反应器和scale-X™上成功培养并用于病毒生产水力固定床生物反应器。使用商业规模的iCellis®500在HEK293细胞中生产腺病毒和慢病毒载体,已证明在固定床生物反应器中扩大规模以产生大量生产批次,这表明该技术为基于贴壁细胞的工艺提供了可行的选择。
微载体工艺开发
微载体上的细胞扩增
绝大多数在搅拌系统中的贴壁Vero细胞生物工艺都是使用微载体技术进行的。这里,细胞附着在珠子上,珠子被设计成在搅拌培养物中保持悬浮状态。微载体有多种类型,主要分为固体载体和大孔载体,其表面性质不同。几项研究比较了不同类型的微载体用于Vero细胞的扩增。事实上,Cytodex 1微载体的使用在过去十年中占主导地位。Cytodex 1微载体是基于葡聚糖的固体微载体,显示平均直径为180µm的带电表面。然而,正在研究用于Vero细胞生长的新型微载体。在不同的条件下,如细胞与载体的比例、培养基成分、搅拌速度或减少体积,研究了培养物接种过程中细胞与微载体的附着。最近,先进的PAT已被用于观察附着过程。相反,为了扩大规模和改进种子培养,已经原位研究了细胞从微载体上的分离。微载体技术可以在搅拌釜生物反应器中进行。生物反应器的一个优点是工艺参数可以放大到更大规模的生物反应器。与放大规模相比,在最终生产阶段之前连续使用更大的容器有望降低运营成本。此外,已经建立了用于动物细胞培养的生物反应器的用途,具有许多不同的配置,并且适合于大规模操作。此外,可以使用按比例缩小的方法在更小、更具成本效益的规模上进行工艺优化实验,这反过来又可以直接转化为改进大规模工艺。此外,搅拌釜生物反应器提供了应用广泛的过程分析技术和过程控制策略的选择。一个关键点是以恒定的速率控制混合保持培养物的均匀性。细胞、营养物质和溶解气体分布均匀,最大限度地减少任何成分的局部限制,并允许准确测量整个过程参数(如温度、pH、溶解氧)。除了对培养物进行在线监测外,生物反应器还允许在不干扰培养物(如细胞计数、代谢物浓度)的情况下对小体积样品进行离线分析。已经建立了使用微载体的生物反应器中的工艺放大。大约40年前,第一个涉及在微载体上生长的Vero细胞的大规模工艺被开发用于生产整个灭活脊髓灰质炎病毒疫苗,迄今为止,已经开发出用于生产高达6000L病毒的培养系统。已经描述了用于放大的种子系的开发,其最终体积为20L、200L、500L和高达1200L。特别是在大规模培养下下,与搅拌速率相关的细胞上的流体动力学剪切力可以对细胞产生显著影响。因此,研究了搅拌速度对微载体上生长的Vero细胞生长的影响。通常,搅拌需要足够高,以保持微载体悬浮在培养物中,并确保均匀混合以及充分的气体转移。同时,应将搅拌保持在最低限度,因为高搅拌速率会因剪切应力而显著损害细胞生长。此外,由于剪切应力降低,发现与通气相比,表层通气可以改善细胞生长。然而,基于泊洛沙姆的剪切保护剂可以保护Vero细胞,这在由于更高的氧气需求而需要通气时尤其重要。在这种情况下,一项研究着眼于使用两个叶轮而不是一个叶轮,以及降低溶解氧设定值。结果,泡沫和聚集体的形成减少,所需的通气量减少,最终降低了细胞上的剪切应力。贴壁过程中的细胞密度受到表面积的限制,表面积由微载体的总数决定。已经研究了不同浓度的Cytodex 1微载体的使用,其浓度范围为1.5至10g/L。虽然一方面较高的微载体浓度始终导致较高的细胞密度,但另一方面也会出现氧气和营养限制等技术挑战。此外,更高频率的直接珠对珠相互作用会损害细胞生长。例如,在分批模式下,在2 g/L、3 g/L和6 g/L的微载体浓度下,Cytodex 1的细胞密度分别达到2.1×106个细胞/mL、2.6×106个单元/mL和3.6×106个细胞/mL。相反,灌流工艺可以产生比分批模式更高的细胞密度。在灌流过程中,不断向培养物中加入新鲜培养基,并以相同的速率去除用过的培养基。这可以通过实现诸如自旋过滤器的截留系统而应用于微载体工艺。在这种情况下,与悬浮细胞培养物中的单个细胞相比,微载体可以更容易地从培养液中分离。已经对分批和灌流模式之间的直接比较进行了广泛的研究,并证明灌流培养具有更高的Vero细胞密度,例如,它可以长时间维持足够的底物水平,并减少抑制副产物的量。据报道,在2 g/L、3 g/L和10 g/L的微载体浓度下,Cytodex 1的灌流过程中,最大细胞密度分别为2.1×106个细胞/mL、4.7×106个细胞/mL和7.8×106个细胞/mL。在将灌流培养物的出口培养基泵入补料容器的再循环模式中,据报道,在Cytodex 1浓度分别为3 g/L和6 g/L时,细胞密度甚至更高,分别为5.5×106细胞/mL和10.1×106细胞/mL。为细胞提供适量的营养是一项复杂的任务,尤其是在高细胞密度的情况下。一方面,研究比较了不同培养基对Vero细胞生长的影响。特别地,在微载体上比较了含血清和无血清条件下Vero细胞的生长。此外,还介绍了Vero细胞无血清培养基的开发和改进。总的来说,由于对污染风险的监管担忧,无血清培养基的使用已经占主导地位,并且是疫苗生产商的首选。此外,血清的不明确性质和批次间的差异使其在制药行业中成为一种担忧。另一方面,当更仔细地观察代谢水平时,研究已经调查了使用不同的底物和补料策略来增加Vero细胞的生长和活率。Vero细胞培养中的主要代谢产物是葡萄糖、谷氨酰胺、谷氨酸、乳酸和氨。分别分析它们的消耗和形成,有助于评估不同规模、不同培养模式或不同生物反应器系统之间的生物工艺的工艺开发。此外,它可以用于确保细胞生长速率不会因限制或抑制代谢物水平而受损,例如通过供给额外的营养物质或根据残留底物浓度调节灌流速率。此外,还开发了一种方法,将葡萄糖和乳酸浓度与生物反应器过程中细胞培养基中的近红外光谱测量值相关联。这项研究利用光纤电极进行现场监测,这可以进一步改进喂养策略。类似地,最近对细胞密度的在线监测进行了研究,可以用于测量生物反应器培养物中的细胞生长和死亡。
微载体培养中的病毒生产
除了加强细胞扩增阶段以获得高数量和高质量的细胞外,建立一种产生尽可能高的病毒滴度的微载体工艺至关重要。与前一节类似,也对不同类型的微载体进行了病毒生产研究。在直接比较中,这取决于病毒哪种类型的微载体在Vero中导致更高的滴度。例如,使用多孔微载体产生的狂犬病病毒生产滴度略高。相反,尽管细胞密度更高,但与固体载体相比,在呼肠孤病毒多孔载体上产生的滴度更低。然而,无孔Cytodex 1的使用在病毒产生阶段也占主导地位,这可能与其在细胞扩增阶段的主要用途有关,如上所述。此外,微载体浓度可以特别针对病毒生产阶段进行优化,如71型肠道病毒所示。特别是对于包膜病毒,生物反应器中的生产可能会受到搅拌和底部通气的剪切力的影响。例如,Grein等人发现麻疹病毒对生物反应器中的剪切应力高度敏感。在某些条件下,通气和搅动可将病毒滴度降低1000倍。在这里,顶部通气能够为Vero细胞培养物提供足够的氧气,同时减少由底通引起的剪切诱导的影响。当在病毒感染的初始阶段应用时,发现降低搅拌速率(如间歇搅拌)可以提高呼肠孤病毒的产生,促进病毒细胞贴壁。然而,这种策略也会降低Vero细胞的生长,这可能是由黄热病病毒研究中发现的混合不足导致的氧气限制引起的。增强呼肠孤病毒和黄热病病毒的病毒细胞贴壁的另一个成功策略是在感染开始时暂时减少工作体积。在进入病毒生产阶段时降低工艺温度是Vero工艺中的一种常见策略。通常,狂犬病病毒和rVSV的生产在34°C下进行,而脊髓灰质炎病毒倾向于在32.5°C下产生,麻疹病毒和71型肠道病毒倾向于32°C。相反,建立最佳MOI是一个高度针对病毒的问题,需要在初步实验中逐步确定。然而,一般策略是选择一种在高最终滴度、短生产时间和保存病毒库存之间具有最佳权衡的MOI。在这种情况下,TOI是另一个关键方面。通常被视为细胞接种和细胞感染之间的时间,它对应于感染时的细胞密度,作为一般原理,许多工艺在细胞的指数生长后期被感染。如上所述,细胞扩增阶段通常旨在提供高细胞密度环境,假设有更多的细胞可用作底物,可以产生更多的病毒。然而,需要考虑细胞基质的条件,并仔细选择TOI。例如,研究发现,在脊髓灰质炎病毒过程中,较高的Vero细胞密度导致较低的细胞特异性脊髓灰质炎病毒D抗原水平,这是通过ELISA量化的生产病毒免疫原性的衡量标准,也是产品质量的指标。尽管如此,总体D-抗原产量在更高的细胞密度下仍然增加。对于Vero中的嵌合病毒生产,也观察到了这种细胞密度效应。Trabelsi等人甚至发现,对于RM-65羊痘病毒,在细胞接种时的感染导致最高的Vero细胞特异性病毒生产力。然而,达到高细胞密度是一种广泛使用的方法,特别是灌流工艺已经被广泛探索。虽然在细胞扩增阶段的灌流可以通过将细胞截留在系统内来增加细胞密度,但由于病毒的体积较小,因此截留病毒相当困难。因此,在病毒产生阶段的灌流模式导致产品的连续收获。在71型肠病毒的情况下,与Vero细胞中的分批模式相比,连续收获的灌流使产量增加了7-14倍以上。同样,对于麻疹和狂犬病病毒的生产,与分批模式相比,灌流期间的连续收获提高了总产量,尽管病毒滴度没有显著差异。虽然在灌流过程中持续提供新鲜和完整的生长培养基是一种选择,但另一种策略是只向培养物中添加选定的营养物质,以提高病毒的产量。例如,在病毒复制阶段添加营养物质已被证明可以增加Vero细胞特异性脊髓灰质炎病毒的产生。在麻疹病毒的产生过程中,补加半乳糖和谷氨酰胺会增加病毒的产生。此外,在71型肠道病毒的情况下,补加葡萄糖和谷氨酰胺甚至将滴度提高了30倍。除了向细胞提供最佳量的营养外,细胞的代谢状态在高细胞特异性病毒生产力方面也发挥着重要作用。一项研究发现,就ATP和腺苷酸浓度而言,较高的细胞能量状态有利于Vero细胞中呼肠孤病毒的产生。最后,确定最佳收获时间(TOH)是生物工艺中的一个关键挑战。TOH可以在初步实验中确定,然后假设在随后的生产运行中是一致的。然而,在实际操作中,单次的运行可能会有很大的变化,因此,对指示参数(如细胞密度、营养消耗、代谢副产物形成或细胞病变效应)的过程进行持续监测,以确定何时收获。为了监测在更复杂的微载体上生长的Vero细胞中病毒复制的进展,在一项研究中成功地使用了介电光谱。研究人员能够根据麻疹病毒产生的在线测量结果预测最佳TOH。近年来,人们对微载体Vero细胞生物工艺的建模进行了研究,目的是更好地了解该工艺并提高病毒的产量。例如,这些模型可以分析MOI和TOI的不同组合,并预测它们对病毒产量的影响。此外,它们可用于研究细胞代谢和感染动力学。这种方法对于确定过程控制策略以及比较和优化工艺非常有用。该领域的挑战是整合与复杂培养基组成相关的大量数据。然而,现代计算技术变得更容易获得,可以使用人工智能,并有助于实时工艺评估。
悬浮培养
灌流培养模式可能更容易应用于微载体或固定床上的贴壁培养,但这些系统面临着表面积是生长限制因素的问题。在悬浮培养中,细胞不会遇到这种限制。此外,由于不需要胰蛋白酶消化,并且建立了其他哺乳动物细胞系如HEK293或CHO的悬浮培养,因此更容易进行放大。现有技术是可以使用的,并且是容易获得的。此外,假设有限的可用表面积或细胞多层即使在病毒感染后也会损害细胞生长并降低病毒生产力。然而,Vero细胞系适应悬浮培养生长是一个非常具有挑战性的过程。Litwin首次报道了Vero细胞作为悬浮聚集体在无血清培养基中的悬浮培养中生长。然而,细胞聚集并不是最佳条件,因为底物、代谢物和产物会产生扩散障碍。因此,单细胞悬浮培养是非常优选的。Paillet等人报道了Vero细胞在单细胞悬浮培养中生长的成功适应。开发了分批和灌流模式的生物反应器工艺,并在这些系统中证明了病毒的产生。然而,这一系统没有得到进一步利用。十年后,人们做出了新的努力,另外两个实验室小组描述了Vero细胞在无血清悬浮培养物中生长的适应性。Shen等人演示了分批和灌流生物反应器的操作,包括通过电容监测生物量,以及该系统中的rVSV生产。尽管这些报告表明了成功的进展,但还需要进行更多的研究来改进Vero悬架系统。加倍时间超过40小时的低细胞生长率和聚集体的频繁形成仍然是重要问题。培养基开发肯定会发挥重要作用,这一点突出表明,没有商业培养基,只有内部培养基能够支持Vero悬浮培养。例如,细胞贴壁在很大程度上取决于细胞周围环境中钙的二价阳离子的浓度,因此浓度降低的培养基可以减少细胞聚集。此外,找到最佳数量的生长因子对提高增长率至关重要。在一项使用DNA微阵列鉴定参与HeLa细胞贴壁的基因的研究中,发现编码II型膜糖基化唾液酸转移酶的SIAT7E基因的表达增加将导致贴壁减少,而负责表达糖蛋白层粘连蛋白α4的LAMA4基因的表达减少也将导致贴壁降低。类似地,用表达SIAT7E基因的质粒转染MDCK细胞以使细胞适应在悬浮液中生长。另一项研究也表明,同样的策略也可以应用于Vero细胞。在siRNA敲低编码脂质磷酸酯酶的PTEN基因后,HEK293T细胞也显示出贴壁性丧失。然而,根据我们实验室的经验,应用这些策略并没有产生有效的悬浮Vero细胞系,我们认为这一挑战过于复杂,无法通过单一的基因修饰来解决。总之,高细胞密度工艺的开发和连续操作可以使细胞悬浮系统成为一种成功的替代方案。尽管建立了微载体和固定床生物反应器技术,悬浮细胞系仍然是生产病毒的最佳基质。
结论
已经工业化的微载体技术为使用Vero细胞系生产病毒提供了一个强大的平台。然而,为了实现更高的病毒生产力,该平台面临着一些挑战。与具有其他动物细胞系的生物工艺相比,Vero细胞密度仍然相对较低,并且通常不超过107个细胞/mL。因此,需要更深入的研究来分析Vero细胞在高细胞浓度下的状态。代谢组学、转录组学和蛋白质组学等新的组学技术可以帮助开发策略,为Vero细胞提供在高细胞密度下生长和产生病毒的最佳环境。除此之外,还需要复杂的流加策略。在这里,底物和代谢物浓度的在线监测与通过补料或灌流速率调节的直接控制相结合,可以加强工艺。另一个关键工艺参数是TOH。使用介电光谱的在线监测系统已经证明了它们的有用性,应该更详细地探索,以优化不同病毒的TOH。一般来说,病毒对温度和剪切应力等培养条件很敏感,在精确的峰值产量下收获有可能显著减少过程损失。此外,将大量数据和人工智能相结合的建模方法越来越容易使用现代计算技术,并有助于实时工艺评估。成功放大工艺规模仍然需要高水平的技术专长和专门知识。线性可放大系统,如固定床生物反应器系统或高度可放大的悬浮细胞培养物,可以使工艺更稳健、更精简、更具成本效益。独立于培养模式提高细胞特异性生产力,可以通过在基因组学和基因工程领域应用新工具来实现。然而,由于可用的基因组数据有限,这些努力受到了限制。因此,对Vero基因组进行完整的注释是必要的。当面临病毒性疾病的突然爆发时,工艺主要依赖于标准模型,只测试少数病毒特异性参数。因此,现在非常有兴趣进一步开发用于加速生产的Vero细胞平台,以便在新病毒出现和目前没有疫苗的疾病传播时,它可以很容易地应用并提供足够的材料。最近的报告表明了做好准备的趋势,但研究活动需要加强。因此,Vero基因组学的进展和悬浮细胞系作为病毒载体和疫苗高产生产平台的进一步开发可能会成为重大贡献。
参考文献:Vero cell upstream bioprocess development for the production of viral vectors and vaccines ; doi.org/10.1016/j.biotechadv.2020.107608 |
以上文章来源于Cell Culture
关于宥艺生物 上海宥艺生物科技有限公司是一家专注于提供商业化培养基、定制化培养基服务的高科技生物技术公司。涵盖CHO细胞培养基、HEK293培养基、Vero细胞培养基、昆虫细胞培养基、杂交瘤培养基,T及NK细胞培养基,干细胞培养基,大肠杆菌CD培养基等。 宥艺生物经过多年开发,开发出高性能无血清、无水解物、超低蛋白浓度的Vero细胞贴壁培养基,产品经过多家公司验证,病毒滴度超过进口最佳培养基。且宥艺生物提供的Vero培养基配制简单,一步加水溶解过滤,极大化精简配制过程。大家有试用宥艺生物Vero细胞培养基需求的话,欢迎联系产品相关负责人——赵经理(18193664815);更详细产品介绍欢迎大家关注宥艺生物官网:www.youyimedium.com。 |


