摘要
细胞培养工艺为传统的基于鸡蛋的流感疫苗生产方法提供了一种可靠的替代方法。然而,大多数仍然依赖于贴壁细胞的培养,这使得工艺放大成为一个具有挑战性的问题。在这项研究中,证明HEK-293细胞系能够有效复制流感病毒。在HEK-293培养物的无血清悬浮液中可以生产出高滴度的不同亚型和变体(包括A/H1、A/H3和B菌株)的感染性流感病毒。在病毒适应和感染条件优化后,在3L生物反应器生产的滴度高达109IVP/mL,证明了该工艺的放大潜力。
介绍
流感病毒是含有包膜、负链的RNA病毒,属于正黏病毒科。血凝素(HA)和神经氨酸酶(NA)是两种易受抗原变异(如“移位”和“漂移”)影响的表面糖蛋白。这使得新的变异病毒粒子能够避免被宿主抗体识别,并导致反复的流感大流行。它们的特点是出现的不可预测性和严重程度。每年有超过20%的人口被感染,其中老年人或非常年轻的人受到的影响最大。据估计,全球每年有250000至500000人死亡,接种疫苗是最有效的预防手段。根据世界卫生组织的建议,年度三价灭活流感疫苗(TIV)由人类最常见的流感毒株(A/H1N1、A/H3N2、B)组成。目前,大多数人类流感疫苗都是在胚胎母鸡的蛋中生产的。这种生产方法得益于数十年的工业经验,因此具有良好的安全性和成本效益。然而,主要的缺点与以鸡蛋为基础的疫苗生产有关。过程的能力有限(大约需要一个鸡蛋才能产生一剂疫苗)、灵活性差和反应能力有限,降低了它们在流行病情况下满足需求的能力。假设在计划期内有足够数量的鸡蛋可用,疫苗生产可能需要大约6-9个月的时间。以鸡蛋为基础的生产过程适应性低,增加了疫苗与循环菌株不匹配的风险。因此,在流感大流行期间,这些限制因素会影响疫苗的生产,特别是当毒株来源于禽(如H5N1)且不能在鸡蛋中生产时。在这种情况下,探索更稳健的替代生产方法变得至关重要。基于细胞培养的生产系统为基于鸡蛋的工艺提供了极具吸引力的替代方案。哺乳动物细胞培养现在被认为是生物制药行业中生产治疗性蛋白质或疫苗的一种成熟技术。生产是在封闭和受控的环境中进行的,可以很容易地转移到工业制造规模。微生物污染的风险显著降低,鸡蛋蛋白引起的过敏反应也不存在。此外,预计细胞培养物产生的疫苗比鸡蛋适应病毒更类似于原始人类分离物,从而诱导更高的交叉反应保护性免疫反应。已经探索了几种哺乳动物细胞系,如Madin-Darbin犬肾细胞(MDCK)、人胚胎视网膜细胞(PER.C6)或猴肾细胞(Vero),用于产生病毒颗粒。MDCK细胞通常被认为是疫苗生产的首选宿主,因为它们对流感病毒的复制具有高度的许可性,并且可以产生与鸡蛋相当的感染性颗粒。然而,这些细胞必须在含有血清的培养基中粘附生长,这使得过程难以扩大,并且需要动物来源的培养基成分。此外,在MDCK或VERO细胞中产生流感可能会在传播到新宿主的过程中引入抗原变化,从而影响病毒的传染性。最近的数据表明,人类流感病毒在人类中比在犬细胞中更有效地分离。HEK-293细胞系已被科学界广泛使用了30多年,主要用于生产用于基因和细胞治疗的病毒载体。HEK-293细胞也已被验证为通过在无血清悬浮培养中瞬时转染大规模生产重组蛋白和病毒载体的有效平台。这种充分记录的细胞系提供了在悬浮液中以高细胞密度(在分批模式下高达107个细胞/mL)和无血清培养基中容易生长的优势。HEK-293细胞的致瘤性已经由不同的实验室进行了评估,最近的一项研究清楚地确立了致瘤性与HEK-293的传代数之间的关系,这解释了文献中报道的相互矛盾的数据。此外,该研究得出结论,就HEK-293细胞的潜在致瘤性而言,低传代培养物(<52)的使用应为监管机构所接受。因此,HEK293细胞维持许多被评估为疫苗或病毒治疗剂的病毒的复制和产生。HEK-293细胞中产生的许多病毒载体目前正在II/III期临床试验中进行评估,伊利百合生产的第一种基于蛋白质的治疗药物已被批准商业化。这表明在生物制品生产中使用HEK-293细胞具有良好的安全性,并可能快速获得监管许可。此外,预计人类细胞系最能满足人类病毒的糖基化需求,以确保有效复制。此外,由于HEK-293克隆对转染的高易感性,它们已与MDCK细胞共同培养,以通过反向遗传技术拯救流感菌株,因此,该细胞系已被用作生产重组流感菌株的策略中的底物。本研究评估了源自cGMP制造的主细胞库的HEK-293细胞作为生产流感疫苗的合适表达平台的用途。在可放大工艺的背景下,介绍并讨论了HEK-293在摇瓶(20 mL)和生物反应器(3 L)中培养和感染流感病毒的数据。在证明HEK-293细胞表面存在流感病毒受体(Sia2-3Gal和Sia2-6Gal)的支持下,进行了病毒对HEK-293的适应,并优化了感染条件(胰蛋白酶浓度和感染的多重性)。测试了各种流感亚型,包括甲型H1N1、甲型H3N2和乙型毒株。所获得的结果表明,HEK-293细胞能够产生高达1010IVP/mL的高感染性病毒滴度,从而证明符合cGMP的HEK-293表达系统是工业化大规模生产流感疫苗的合适平台。结果和讨论
HEK-293 cGMP细胞上的HA表面受体
HA是主要的抗原决定簇,负责病毒附着在含有唾液酸的宿主细胞受体上,并在感染过程中进行膜融合。为了评估HEK-293细胞作为生产流感病毒的常见贴壁细胞系统的潜在有效替代品,研究了细胞表面Sia2-3Gal和Sia2-6Gal HA受体的存在,如先前对其他细胞类型所述。使用DIG标记的凝集素的FACS分析清楚地证明了Sia2-6Gal和Sia2-3Gal在HEK-293细胞的膜上的出现(图1)。检测结果与MDCK阳性对照相一致,显示出两种凝集素的存在。HEK-293和MDCK细胞都表达了与两种受体相似的高荧光信号。相反,正如预期的那样,CHO阴性对照细胞显示出SNA结合的效率,因为这些细胞中缺乏相应的Sia2-6Gal唾液酸转移酶。因此,HEK-293细胞表面两种受体的存在提供了一个早期迹象,表明该细胞系可以支持流感病毒的生长,并代表了生产流感疫苗的替代宿主系统。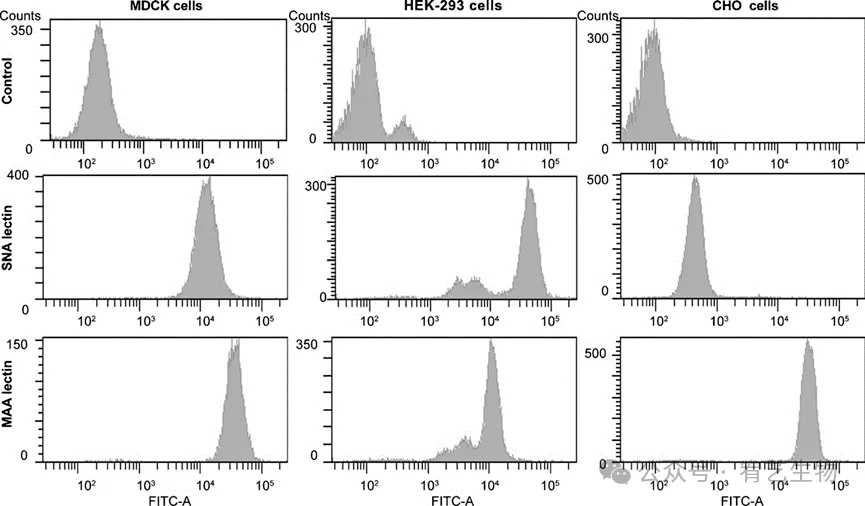 图1:Sia2-3Gal和Sia2-6Gal受体在HEK-293细胞表面的表达。不使用(对照)或使用DIG标记的SNA或NAA凝集素孵育的MDCK、HEK-293和CHO细胞的FACS分析。细胞数与凝集素染色的细胞的荧光强度作图,与FITC抗DIG抗体一起孵育。
图1:Sia2-3Gal和Sia2-6Gal受体在HEK-293细胞表面的表达。不使用(对照)或使用DIG标记的SNA或NAA凝集素孵育的MDCK、HEK-293和CHO细胞的FACS分析。细胞数与凝集素染色的细胞的荧光强度作图,与FITC抗DIG抗体一起孵育。使用HEK-293细胞的流感病毒传播通过免疫荧光进行确认和监测(图2)。在未感染的细胞中未检测到信号,但A/PR/8/34感染的细胞在24小时开始荧光,这表明流感病毒复制显著。感染细胞的数量逐渐增加,直到48 hpi,同时细胞活力保持较高(>80%)。细胞病变效应(CPE)是在感染流感的宿主细胞中观察到的形态学变化的特征,在72和96 hpi后清晰可见。在这些时候,细胞要么表现出明显的体积缩小,要么呈碎片状。因此,这些结果表明,HEK-293细胞确实可以被A/PR/8/34流感毒株感染。
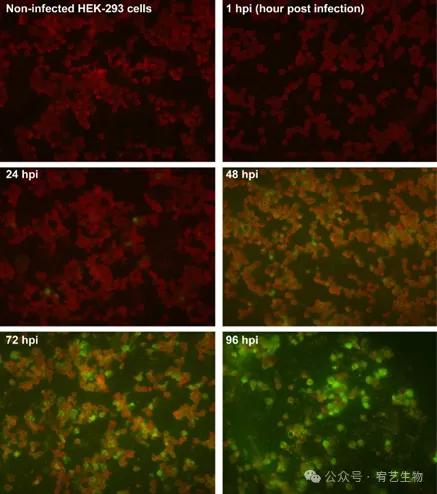
图2:通过免疫荧光监测流感病毒的传播。在10−3的moi处用A/PR/8/34感染HEK-293细胞。固定后,用荧光素标记的抗体制剂检测HEK-293细胞,该抗体制剂专门用于甲型流感病毒的M和NP蛋白(×400)。
胰蛋白酶对病毒生长的影响
只有在形成高传染性颗粒的情况下,病毒才能在宿主系统中连续传播。细胞病变效应与胰蛋白酶处理激活流感病毒颗粒之间似乎存在相关性。胰蛋白酶显著增强几种流感病毒株的传染性,将血凝素糖蛋白HA裂解为HA1和HA2。尽管病毒组装和释放不需要这一步骤,但病毒颗粒的激活取决于这种切割。然而,这是一种依赖宿主的现象,具有细胞蛋白酶活性。因此,在PER中需要胰蛋白酶激活。C6或Vero细胞,但在AGE1.CR细胞中没有。因此,研究了胰蛋白酶对HEK-293细胞的影响和感染的结果,因为它可能会提高病毒产量。在初步实验中,在没有病毒感染的情况下,向VGM中添加5 ug/mL胰蛋白酶显示出对HEK-293细胞生长的抑制作用,导致细胞在2天内完全死亡。在较低浓度下,细胞继续生长,但仅达到在常规HyQ培养基中通常观察到的最大细胞密度的一半(数据未显示)。因此,胰蛋白酶仅在感染时添加到培养物中。然后在含有不同浓度胰蛋白酶-EDTA(0、1、2.5和5ug/mL)的VGM中用A/PR/8/34病毒(moi=10−3)感染HEK-293细胞,并通过HA测定监测病毒传播。胰蛋白酶浓度对产生的病毒滴度有显著影响(图3B)。在没有胰蛋白酶的情况下,即使在感染后4天,在培养基中也检测不到病毒颗粒(感染或未感染)。HEK-293细胞继续以与未感染的细胞对照相同的方式生长,显示出可比的细胞密度或活力,并在生长阶段经历代谢转变(约4-5×106个细胞/mL)(图3A)。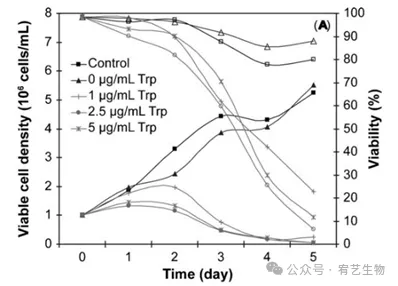
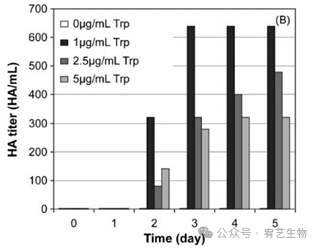
图3:胰蛋白酶和moi对流感病毒产生的影响。如图所示,使用0至5 ug/mL的不同胰蛋白酶(Trp)浓度,用VGM中的A/PR/8/34(moi为10−3)感染HEK-293细胞。在感染后的不同时间点测量培养上清液中的细胞密度(封闭符号)、活率(开放符号)(A)和HA滴度(B)。
添加胰蛋白酶后,观察到的细胞浓度变化是典型的病毒感染。细胞生长在感染第一天后停止,培养物在感染后2天内进入死亡阶段,导致细胞密度和活力下降。病毒颗粒的产生也随着所用胰蛋白酶浓度的变化而显著变化。在胰蛋白酶的最低非零浓度(1 ug/mL)下获得最高HA滴度(600 HA/mL),并且发现其通常随着胰蛋白酶浓度的增加而降低。在不存在胰蛋白酶的情况下,在HEK-293细胞中未检测到病毒颗粒。因此,可以假设产生的病毒粒子没有被宿主细胞蛋白酶充分或有效地激活,并且不能通过感染其他细胞来繁殖。因此,添加胰蛋白酶显然是增强A/PR/8/34流感病毒感染性并使其在HEK-293宿主细胞中复制所必需的。当HEK-293细胞暴露于5 ug/mL的胰蛋白酶浓度时,未感染的细胞(初步实验)显示出比感染流感病毒的细胞更高的死亡率,这表明在5 ug/mL胰蛋白酶浓度条件下,感染流感病毒可能会延迟HEK-293细胞的死亡。这些观察结果与研究结果一致,研究报告称,病毒感染会阻断宿主蛋白质的合成,并延缓细胞凋亡过程,从而允许病毒复制。moi对流感病毒产生的影响
为了研究多重感染(moi)对流感病毒产生的影响,以1ug/mL的胰蛋白酶浓度感染HEK-293细胞。对A/PR/8/34流感病毒株的各种moi进行了测试(moi=1、10−1、10–3和10−5),并通过HA测试监测病毒产生(图3C)。
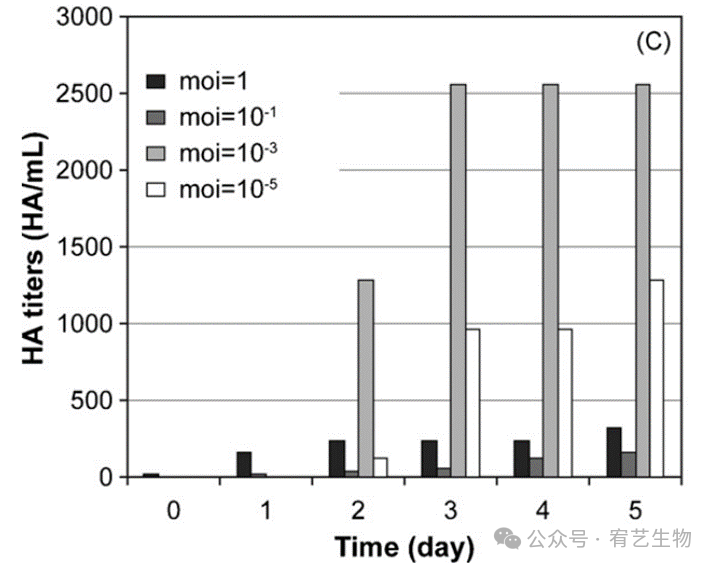
图3:在HyQ培养基中的一批HEK-293细胞作为对照。然后在含有1ug/mL胰蛋白酶(C)的VGM中进行Moi研究。
对于所有感染的培养物,感染动力学与先前的胰蛋白酶研究相似(数据未显示)。尽管对于1的moi在24 hpi后活率迅速下降,但对于较低的moi,在48 hpi后观察到这些影响。这种延迟似乎是用于感染的病毒颗粒数量的函数,对应于病毒感染细胞并通过关闭宿主细胞代谢开始复制所需的时间。典型的感染动力学包括感染早期细胞内病毒成分的产生和积累,以及复制周期结束时病毒从宿主细胞出芽。当HEK-293细胞被高病毒载量(moi=1)感染时,培养基中的一些残留病毒在感染后仍能立即通过HA测定检测到。相反,当HEK-293细胞用10−1或更低的moi感染时,在1 hpi时无法检测到病毒。感染动力学似乎是用于感染的moi的函数。在moi为1的情况下,仅在24 hpi内观察到总病毒滴度的增加,HA滴度保持较低(~300 HA/mL)。在10−1的moi下也进行了同样的观察,这也导致了低颗粒产量(<200 HA/mL)。然而,在10−3和10−5的较低moi下获得了更高的病毒产量,分别获得2500和1300 HA/mL的滴度。这些观察结果与MDCK细胞的结果相似,表明使用10−4的moi会使HA滴度比使用1的moi增加4倍。当HEK-293细胞在10−3的moi感染时,在较晚的时间点达到子代病毒滴度的最大值(72 hpi时为2500 HA/mL),这比使用1的moi时晚了48小时。这些结果证实了最近的文献发现。MDCK细胞在低moi下的感染导致病毒粒子的产生,该病毒粒子在随后的几轮感染中感染剩余的细胞,直到所有细胞都被感染。已经进入凋亡途径的细胞不会进一步促进病毒的产生。事实上,只有处于感染早期的感染细胞,其细胞内病毒蛋白浓度较低,才会产生病毒成分。在感染的后期观察到,高水平的细胞内病毒蛋白会导致细胞进入凋亡途径,从而停止病毒的产生。然而,由于培养基中存在病毒成分,作为防止病毒复制的宿主防御机制,未感染细胞的凋亡可以在没有感染的情况下被诱导。在本研究中,moi=1时的感染,即感染后仍存在残余病毒,在有效产生病毒之前,可能会类似地诱导细胞群凋亡。相反,对于10−3和10−5的较低moi,随后诱导细胞凋亡,并在所有细胞凋亡并进行细胞裂解之前发生连续几轮感染。病毒颗粒主要产生于感染的早期阶段(24-48 hpi)。在该时间点之后,HA滴度保持高,没有进一步的产量增加。病毒的释放与CPE的出现有关。总之,在高moi下,可存活的病毒产生细胞的数量在感染后不久减少,并导致较低的病毒产量。这可以通过低moi的感染来克服,这可以最大限度地减少早期细胞死亡并增加病毒产量。因此,在所有随后的实验中使用了与所获得的最大病毒产量相对应的10−3的moi,在感染时胰蛋白酶浓度为1 ug/mL。
使用HEK-293细胞生产不同的流感菌株
由于季节性流感疫苗由三种毒株类型(A/H1N1、A/H3N2和B)组成,因此评估HEK-293细胞是否能够可靠地产生所有所需毒株至关重要。因此,使用所建立的感染参数,测试了几种菌株在HEK-293细胞上的增殖。其中包括A/WS/33(H1N1)、A/Aichi/2/68(H3N2)、A/neneneba香港/8/68(NH3N2)、B/Lee/40和A/PR/8/34。所有这些菌株最初都是MDCK适应的,并且在没有先前适应的情况下直接用于感染HEK-293或MDCK。因此,HEK293和MDCK细胞的感染是在补充了1 ug/mL胰蛋白酶的VGM中以10−3的moi进行的。两种细胞系都被不同的流感菌株有效感染,并在感染后几天开始显示出明显的CPE(dpi)。HEK-293细胞比MDCK细胞晚24小时显示出感染的早期迹象。当所有条件下达到最大HA滴度时,在收获时对感染滴度进行定量。测试的五种流感菌株对HEK293细胞产生的感染滴度为105至107 IVP/mL,对MDCK产生的感染效价为108至1010 IVP/mL。对于所有测试的MDCK适应菌株,结果表明MDCK在第一次传代时比HEK-293细胞产生更多的病毒颗粒。然而,任何不同的亚型都可以通过HEK-293细胞有效扩增,而无需任何事先适应,因此这些细胞可以直接用于流感病毒的生产。流感病毒具有在病毒传播过程中适应新宿主的能力。为了进一步研究病毒适应的影响,通过连续三代将菌株适应于HEK-293细胞。结果表明,A/PR/8/34、A/WS/33和B/Lee/40的感染性病毒滴度分别提高了230、430和87倍,达到了108-1010IVP/mL的高感染性滴度。有趣的是,HA和获得的感染滴度之间没有相关性,因为病毒激活是细胞和菌株依赖性的。例如,A/PR/8/34 HA滴度在两种细胞系中相似(2560 HA/mL),尽管在适应后仍观察到1.5 log的感染滴度差异。与HEK-293细胞相比,MDCK细胞可能最能激活该A/PR/8/34菌株。对于另一种H1N1毒株,HEK-293细胞允许A/WS/33扩增超过2.5 log,达到4×1010 IVP/mL,超过MDCK感染滴度。然而,对于其中一种H3N2菌株,在适应时观察到传染性的显著丧失,这可能是由于HEK-293细胞中该特定亚型的感染条件较差。需要用不同moi和胰蛋白酶浓度进行额外实验,以确定能够有效扩增该菌株的特定感染条件。先前的研究还表明,在相似的培养条件下,但来自不同来源的同一流感毒株和对病毒敏感的细胞株,可以观察到病毒颗粒释放量的显著差异。因此,病毒适应是影响HEK-293细胞中流感病毒有效产生的另一个主要参数。可以假设,通过允许更多的传代或使感染参数适应每种特定菌株,滴度可以进一步提高。HEK-293细胞中产生的流感病毒的表征
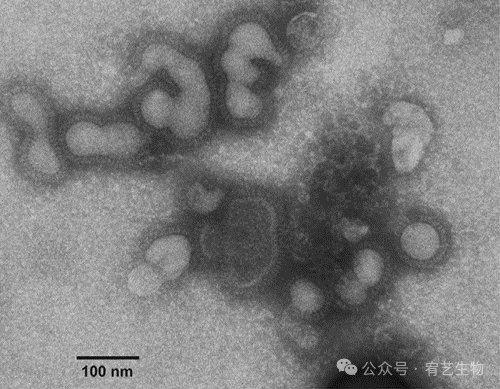
在进一步提高流感病毒的产生之前,需要对HEK-293细胞中产生的A/PR/8/34流感颗粒进行表征。通过阴性染色电子显微镜分析含有纯化病毒的上清液。分析显示,出芽颗粒的平均尺寸(102±20 nm)和形态相当均匀,纯化后80%以上的流感病毒颗粒仍然完好无损(图4)。多形性病毒粒子群体显示出对应于其表面存在的HA和NA病毒糖蛋白的典型尖峰。这些变形的出芽颗粒在大小和形态上似乎与在外源胆固醇存在下在MDCK细胞上产生的颗粒相似。外源性胆固醇被证明可以抑制病毒的释放,并产生变形和细长的颗粒,多个不完整的芽相互附着。不规则颗粒的第二个来源可能与细胞破坏有关,因为芽闭合非常不有效,只有一小部分芽被释放,而大多数芽仍附着在细胞膜上。然而,造成观察到的广泛A/PR/8/34病毒异质性的原因尚不清楚,宿主在病毒形态中的作用需要进一步研究。NSEM还允许总病毒颗粒的定量为1.68×1010 TP/mL。根据该方法,计算出感染性颗粒物(样本滴度:9.25×108 IVP/mL)占总颗粒物(IVP/TP)的百分比为~5%。这一低百分比可以解释为,出芽可能发生在缺乏vRNP或vRNP不完整的情况下,从而导致大多数非传染性病毒被释放(≥90%)。
图4:在HEK-293细胞中产生的A/PR/8/34形态。阴性染色电子显微镜显示高度多形性的病毒粒子状态良好,平均大小为102±20nm(60000×)。每个病毒粒子在外部都呈现出尖锐的条纹和明显的尖峰(比例为100nm)。Nayak等人解释了外源性胆固醇引起的变形颗粒的产生。
此外,WB分析和胭脂红染色证实了培养上清液中存在正确切割的HA,检测到分子量分别约为60和30kDa的HA1和HA2亚基(图5B)。在起始材料和一些纯化组分中观察到大小为~90kDa的未清洁形式(HA0)。HEK-293中产生的流感HA亚基与MDCK或鸡蛋中产生的HA亚基相似。在纯化的级分中仍然可以观察到宿主细胞衍生的污染物(图5A)。需要做更多的工作来评估这些未知条带是与病毒相关还是与非病毒相关,但这超出了这项工作的范围。在浓缩和纯化的级分中,所有三种HA形式都存在。这些结果表明,HEK-293细胞中产生的流感颗粒被激活,并呈现出感染细胞和复制所需的所有流感病毒特征。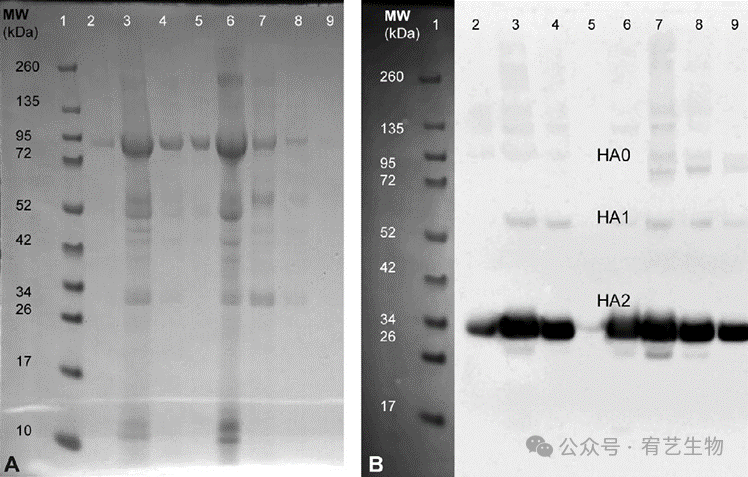
图5:流感A/PR/8/34的SDS-PAGE(A)和蛋白质印迹(B)分析。对纯化前和每个纯化步骤的样品进行分析。通过蛋白质印迹,未还原的HA0(95 kDa)和还原的HA1(63 kDa和34 kDa条带清晰可见,特别是在纯化的级分中。泳道1:标准分子量;泳道2:上清液;泳道3:苯甲酸酶处理+0.45μm过滤;泳道4:18%碘克沙醇含病毒;泳道5-9:纯化的级分1-5。感染时细胞密度对病毒产生的影响
设计了一组实验来确定细胞密度对病毒产生的影响。这些实验是在感染时不进行培养基交换的情况下进行的;因为这样的操作很难转换成工业规模。从同一批培养物中取出细胞,并以0.5、1、2、4和6×106个细胞/mL依次感染。除了最高密度外,其他细胞都处于指数生长期。在感染后的所有培养物中观察到相似的细胞浓度分布(图6A),细胞在感染后24小时保持生长。此后,细胞活力在2 dpi内急剧下降至小于50%。在培养物以6×106个细胞/mL感染的情况下,在生产图谱中观察到24小时的变化。发现HA滴度随着感染时细胞密度的增加而增加(图6B)。除最高细胞密度外,细胞密度每增加2倍,HA滴度就会增加2倍。在以4和6×106细胞/mL感染的两种培养物中,在48–72 hpi时获得的最大HA滴度均为10240 HA/mL。类似地,感染滴度从对应于最低细胞密度(0.5×106个细胞/mL)的107增加到以4和6×106个细胞/mL感染的培养物在72 hpi时的最大109 IVP/mL(图6C)。可以注意到,活率下降得越早,病毒就越早被释放。与HA滴度相似,与4×106个细胞/mL相比,最高细胞浓度(6×106个细胞/mL)的感染滴度没有进一步增加。除了感染时的细胞密度之外,可能还有一些代谢限制阻碍了感染期间总的和感染性病毒颗粒的产生。特异性生产是根据3 dpi的感染滴度计算的。以4×106个细胞/mL不进行培养基交换的感染导致了最有效的生产条件,与以1×106个细胞/mL不更换培养基的感染相比,特异性生产增加了3倍。对于4×106个细胞/mL,我们观察到HA滴度在2 dpi时接近其最大值,并随着时间的推移保持稳定,而感染性滴度在2 dpi时似乎达到最大滴度(4.26×109 IVP/mL),在4 dpi时降至109 IVP/mL以下。当活力降低到低于50% 2 dpi时,达到了这个最大值(图6D)。该感染滴度是在培养期间以5.82×106个细胞/mL的最大细胞密度获得的,这对应于每个细胞732个感染颗粒的最大特异性产生。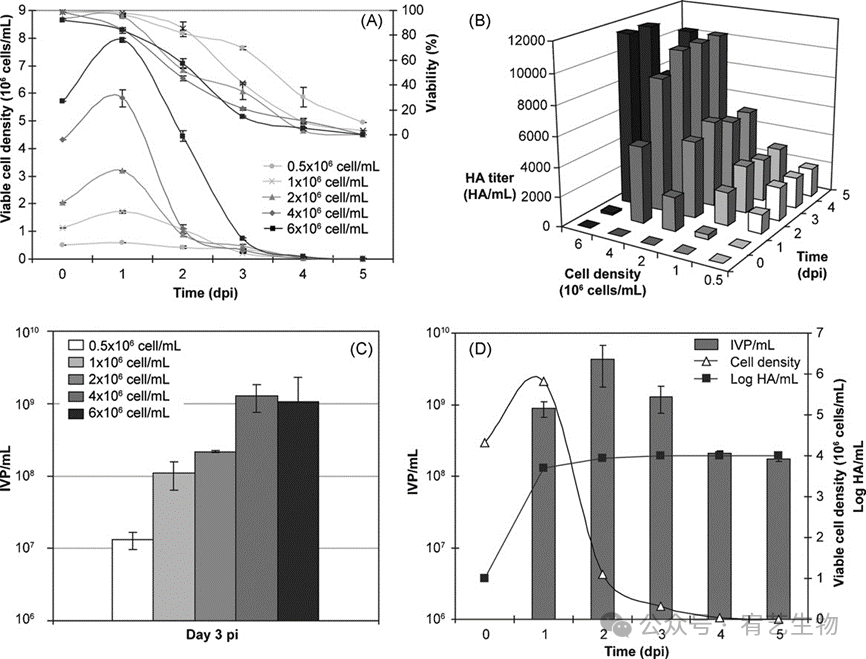
图6:感染时细胞密度的影响。用A/PR/8/34以0.5至6×106个细胞/mL的不同细胞密度感染HEK-293细胞,在感染前不进行培养基交换。在不同密度(A)下观察到类似的动力学过程。在感染后不同天收集的培养上清液中测定HA(B)和感染滴度(C)。×106个细胞/mL的密度(D)与生长和病毒产生动力学相关。
与以1×106个细胞/mL感染的初始培养物相比,将细胞密度增加4倍可使HA滴度提高4倍,感染滴度提高1个log。还应强调的是,消除培养基交换步骤(1×106个细胞/mL条件)并没有显著改变感染滴度,尽管产生了半特异性。这些结果证实了先前生物反应器的改进,表明MDCK感染不需要洗涤步骤和培养基交换。由于感染滴度随时间不稳定,生物反应器中的培养物收获应在2或3 dpi内进行,这取决于细胞密度和活率。随后,发酵产量似乎一方面取决于高细胞产量,从而使宿主细胞最佳生长,另一方面也取决于收获时间、moi和VGM的胰蛋白酶浓度。3L生物反应器中流感病毒的产生
消除感染前的培养基交换步骤是工艺稳健性和降低原料成本以及将污染风险降至最低的主要优势。然而,由于培养时间的延长,底物可能会受到限制,代谢物可能会积累到抑制水平。然后测量底物和代谢物的吸收和释放,以记录使用先前描述的优化条件的工艺的可放大性。将细胞以0.15×106个细胞/mL的密度接种在3L生物反应器中,并在不更换培养基的情况下以~4×106个细胞/mL的密度感染。用HA和TCID50测定产量,生物反应器参数,如pH、温度、溶解氧在运行过程中保持恒定,同时在线监测吸氧速率(OUR)和介电常数信号(图7A)。该工艺的第一阶段(0-97小时,“细胞生长”)表示HEK-293细胞在生物反应器中的生长,导致OUR从0增加到0.5 mmol/L小时(图7A)。接种后4天,在97小时感染细胞。在感染时,细胞仍处于指数期,活率为96%,因为批处理对照细胞继续生长至进入平稳期前145小时(数据未显示)。如先前所观察到的,在细胞生长平稳期之前,受感染的细胞在感染后(hpi)继续生长24小时(图7B)。在24hpi时达到的最大活细胞密度仅为4.37×106个细胞/mL,表明感染后HEK-293细胞不再处于最佳生长条件下。活率在24小时后急剧下降。与细胞生长平行,耗氧量在24小时内增加,然后减少,并在病毒复制后所有细胞死亡(97–190小时,“病毒产生”)约190小时(=93小时)时完全停止。正如先前对HEK-293和其他几种细胞系所报道的那样,在生长阶段(感染前),OUR和电容信号都与活细胞密度密切相关。感染后OUR继续增加,并在24小时左右达到最大值(图7A)。OUR峰值似乎与病毒产生动力学有关。这表明使用OUR或电容信号来在线确定病毒收获的最佳时间点。OUR和病毒产生之间的关系已经被观察到,因为在病毒复制过程中,氧气需求开始随着细胞活力的降低而降低。感染后,延迟24 hpi后,可以通过HA和TCID50测定来定量病毒滴度(图7B)。在3L生物反应器培养物中测量的HA和感染性滴度与摇瓶实验中获得的滴度相似。在2 dpi时,病毒的最大产量达到10240 HA/mL(4.01 log HA /mL)和2.81×109 IVP/mL,相当于每个细胞643个感染性颗粒的最大特异性产量,与摇瓶实验中在类似条件下获得的732个IVP/细胞的最大特性产量相当。如前所述,感染后142小时达到最大感染滴度,感染后两天细胞活力接近70%(图7B)。尽管已知非最佳细胞生长会对病毒产量产生重要影响,但在感染时相同细胞密度的情况下,所获得的滴度和特异性产量与小规模获得的滴度或特异性产量相当。感染后,病毒滴度在延迟24小时后增加,而在4小时内可以观察到氨基酸代谢的第一次变化(图7D)。总的来说,病毒的产生过程可以描述为两个不同的阶段:(1)0–24 hpi病毒进入和代谢转换,(2)24–93 hpi病毒积累、细胞损伤和细胞内代谢产物释放到培养基中。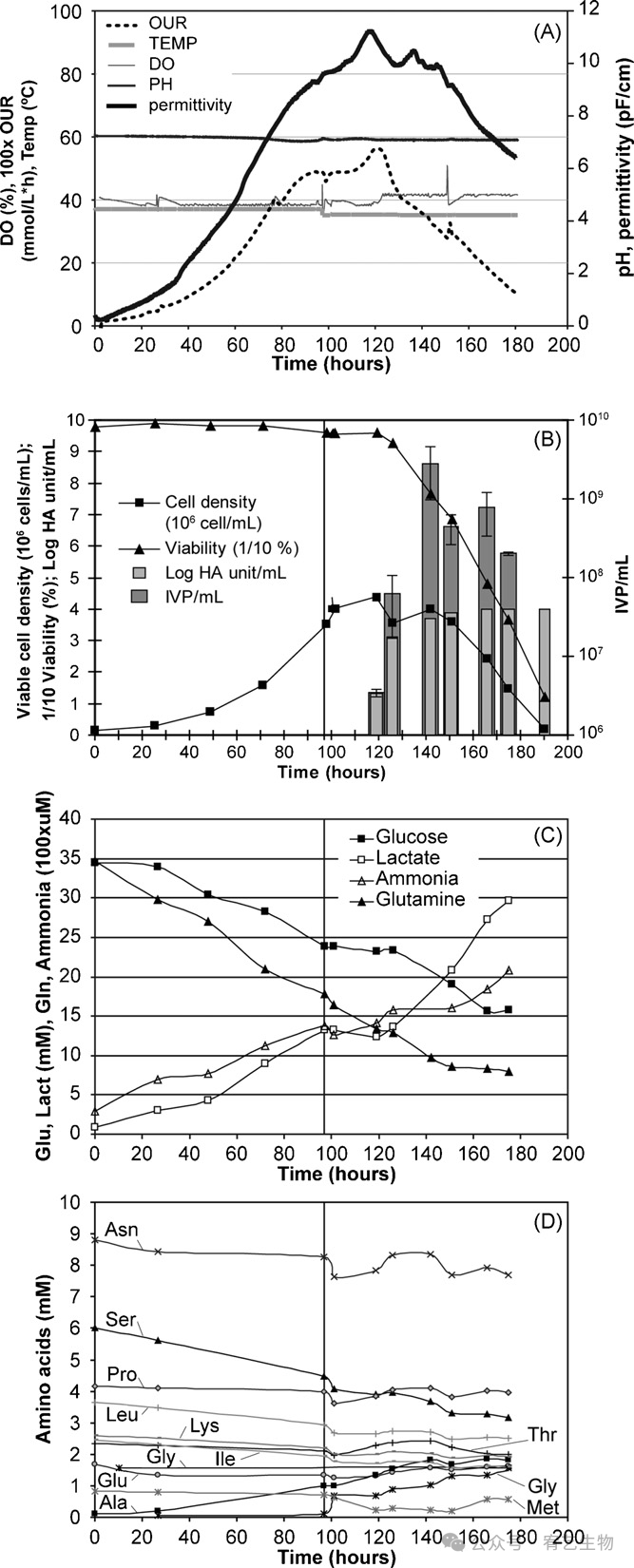
图7:在3L生物反应器中进行发酵生产。生物反应器监测数据(A)活细胞密度、活率、HA和感染滴度(B)随时间绘制(重复的±S.D.)。每天测量葡萄糖、乳酸、谷氨酰胺和氨(C)。垂直线表示没有培养基交换的感染时间(97小时)。在可放大的工艺中,感染性和总颗粒滴度均保持在10240 HA/mL和109 IVP/mL。
葡萄糖、谷氨酰胺、乳酸和铵的代谢产物浓度数据如图所示(图7C)。葡萄糖和谷氨酰胺作为碳源,在细胞生长过程中没有完全消耗,也没有达到极限浓度。就在感染之前,葡萄糖浓度仍为23.8mM,谷氨酰胺浓度为17.5mM。可以比较代谢物的总消耗量和总产量。在细胞生长(97小时)期间,从消耗的10.9mM葡萄糖产生12.9mM乳酸,导致Ylac/gluc的总摩尔产率=1.18。在病毒产生过程中,8.0mM葡萄糖被代谢为15.8mM乳酸(75hpi),对应于Ylac/gluc=1.98。1.72mM谷氨酰胺的降解和摄取在细胞生长过程中导致1.09mM铵,导致Yamm/gln的总摩尔产率=0.63。在病毒复制期间,仍然使用0.97mM谷氨酰胺,并导致0.71mM铵的产生,因此Yamm/gln=0.73mM。在感染阶段,受感染的HEK-293细胞表现出葡萄糖摄取率和乳酸产生率的增加。与葡萄糖相比,谷氨酰胺的消耗和氨的产生在感染前后没有显著变化。在病毒产生过程中,氨基酸浓度在前10小时内发生变化(图7D),但此后没有观察到明显的限制。对于感染流感病毒后的MDCK细胞也报道了类似的观察结果。据报道,HEK细胞的糖酵解流量在感染期增加,因为细胞变得更加氧化,尤其是在感染期开始时。这可能与病毒蛋白质合成所需能量的增加有关。
结论
为了使疫苗生产具有商业价值,哺乳动物细胞系应经过良好的培养,最好在无血清培养基中悬浮生长至高细胞密度,并支持在短时间内将所有流感A和B毒株复制到高滴度。目前的工作表明,HEK-293细胞满足这些要求。通过改变moi,病毒产量变化很大,表明该参数在HEK-293细胞感染中至关重要。通过在低moi(10−3 IVP/细胞)下感染细胞获得最佳结果。对感染培养基中胰蛋白酶浓度的影响的分析也显示了所得产率的变化,并在标准条件下设定为1ug/ml。使用不含血清和动物成分的商业培养基,流感病毒的产生仅限于4×106个细胞/mL以上。由于观察到循环流感病毒的频繁抗原变化,流感疫苗生产需要生产细胞系具有强大的能力,能够从流感病毒的各种亚型和抗原变体中产生高病毒滴度。我们证明,HEK-293细胞易于在无血清培养基中悬浮生长,能够对不同亚型A/H1、A/H3和B菌株产生高滴度的感染性流感病毒,而无需任何事先适应。在病毒适应细胞并扩大到3L生物反应器后,优化的感染条件导致高感染病毒滴度高达109IVP/mL,类似于用MDCK参考细胞系获得的感染病毒滴度。产生的病毒颗粒具有传染性,并呈现出流感病毒的所有特征。因此,我们得出结论,我们的符合cGMP的工业HEK-293表达平台可能是一个适合于流感疫苗工业生产的系统。
关于宥艺生物
上海宥艺生物科技有限公司是一家专注于提供化学成分限定商业化培养基、客户定制化培养基的研发及生产,培养基配方开发及优化服务的高科技生物技术公司。涵盖CHO细胞培养基、HEK293培养基、Vero细胞培养基、昆虫细胞培养基、杂交瘤培养基,T及NK细胞培养基和干细胞培养基等。致力于解决未被满足的培养基市场需求及拓展培养基应用领域,经过2年的研发已经建立完善的6大培养基产品线:
关注宥艺生物微信公众号:欢迎咨询宥艺产品,宥艺生物将免费提供测试产品。
网址:www.youyimedium.com
邮箱:bd@youyimedium.com
联系电话:18193664815